
口疮性溃疡(RAS,复发性阿弗它口腔炎)是内科医师和牙科医师最常遇见的口腔软组织炎症。RAS在世界各个地方的人种中都有发生,并且没有任何明显的种族差异。本病的发病率因地理位置不同而变化在5%~25%之间,。在某些特定的人群中发病率可高达40~60%。三分之二的人在一生之中都会至少发生一次RAS。在发达国家中,大约1%的儿童发生过RAS,一般5岁时开始出现,在10~19岁之间出现发病率的高峰。在儿童中,女性RAS的发病率高于男性,而且社会经济水平较高儿童的发病率高于那些社会经济地位较低的儿童。

RAS是一种自限性慢性口腔黏膜疾病,临床表现为单个或多个复发性疼痛性溃疡;可出现在颊部黏膜、口唇、舌以及软腭。“口疮”这一名词指的是侵袭口腔粘膜的一种疾病。
分类、诊断标准及自然病史
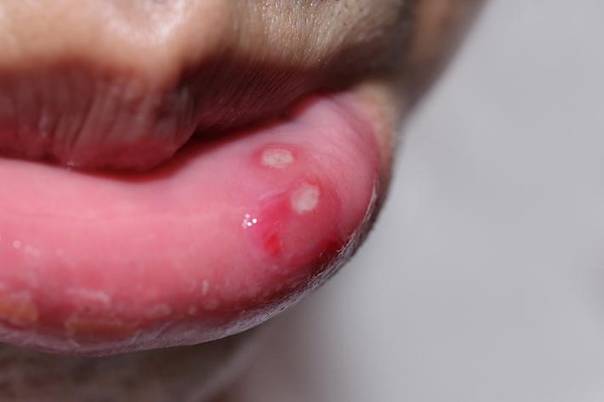
根据病变的大小、位置、病程以及愈合后是否会遗留疤痕形成而将RAS分为三种类型:小型口疮性溃疡病(MiAU)、大型口疮性溃疡病(MjAU)以及疱疹样口疮性溃疡病(HeAU)。
小型口疮性溃疡病MiAU是最为常见的类型(约占80%),为一个到三个小型(<1.0厘米=散在的浅表的卵圆形和圆形溃疡。这些疼痛性溃疡是由黄色到褐色的脓性纤维蛋白膜组成,周边为红斑带。MiAU常在7~10天内愈合,且不留瘢痕。1911年,Sutton描述了10~15%的RAS患者可出现复发性坏死性黏膜腺周围炎,即MiAU。在临床上,这些溃疡一般较大(>1.0厘米)较深而且愈合较慢(15~30天),愈合后常遗留下瘢痕形成。HeAU,是第三种也是最为少见的一种类型(约占5%左右),表现为广泛侵犯口腔黏膜的多组小型溃疡。发展到后期阶段,这些溃疡可以融合在一起形成大型的不规则病变。“疱疹型”这一名称已被广泛采用,但不幸的是,这一名称也会给临床带来误解,而事实上这些溃疡与疱疹病毒并无关联。
口疮性溃疡RAS的形成一般有四个步骤:(1)先兆期;(2)溃疡前期;(3)溃疡期;(4)愈合期。在先兆期即最初的24小时,患者感觉溃疡即将发生的部位出现灼热刺痛感。溃疡前期一般持续18~72小时,其特征是红晕环绕的斑点或丘疹。在溃疡前期,疼痛非常剧烈。在溃疡期,丘疹破裂,这一部位由脓性纤维蛋白膜覆盖。愈合期的时程视RAS的大小以及类型而为数天至一个月不等。
RAS与其他口腔溃疡的鉴别
偶可出现与口疮性溃疡RAS难以鉴别的溃疡,如药物副反应导致的溃疡以及作为系统性疾病的一种临床表现的溃疡,如爱滋病、白塞病、肠炎(克隆病和溃疡性结肠炎)以及PFAPA综合征(周期性发热、口疮性溃疡、咽炎和淋巴结炎)。这些引起口腔溃疡的疾病常与RAS相混淆。但是,通过仔细询问病史以及临床评估,常常可以将RAS同这些疾病区分开来。
RAS大多出现在二十岁以前,很少出现在40岁以后。口疮性溃疡病十分疼痛,几乎全部都位于可移动的非角化的口腔黏膜而不发生于牙龈或硬腭等部位。口疮性溃疡大多是黄色到褐色的散在的病变,呈圆形或卵圆形。很少见到硬化或火山口状溃疡。
RAS的这三种类型即MiAU、MjAU以及HeAU所表现的临床特征包括了所有慢性和急性溃疡病的临床表现。
1、遗传基础
RAS在单卵孪生兄弟姊妹中有显著相关性,但是在异卵孪生兄弟姐妹中则无此相关性。大约40%的RAS患者有阳性家族史。这些人群常常在年轻时出现口腔溃疡,而且其复发率比那些没有家族史的RAS患者要高。与某些HLA亚型的相关性更进一步支持了RAS具有遗传学基础。
2、作为辅助因素的微生物在发病机理中的潜在作用
在RAS的发病机理和病原学中,涉及到了疱疹病毒和细菌微生物比如链球菌和幽门螺旋杆菌。支持这一观点的是在病变组织或外周单个核细胞中检测到了病毒或细菌的染色体DNA,并出现了针对某些特定微生物的IgG或IgM抗体的反应。
(1)疱疹病毒
RAS的发作性和自限性特征,溃疡可以由机械性外伤激发以及一些有关于无环鸟苷治疗RAS有效的个案报道都表明疱疹病毒与口疮性溃疡有关。试图证明二者之间相关性的困难是,成年人中针对不同疱疹病毒产生的血清抗体阳性发生率很高,这表明普通人群中,大部分人曾经感染过这些种病毒。
这里存在提示性而非结论性的证据表明,在RAS的病原学中,单纯疱疹病毒、带状疱疹病毒、巨细胞病毒,EB病毒或人类6型疱疹病毒以及8型疱疹病毒有一定的作用。有人认为这些微生物在RAS中的作用并非是以前提到的疱疹病毒在RAS中具有直接致病的作用,理由如下:
1、 不能分离或培养出任何存在于口疮性溃疡中的病毒
2、 口疮性溃疡不能通过患者与患者之间的直接接触传播
3、 阳性血清学改变以及RAS病变中病毒DNA的存在可能是唾液腺中的病毒共同感染或重复感染的一种表现。
4、 免疫抑制剂如激素对RAS损害有效,但抗病毒药物对此损害通常无效。
(2)溶血性链球菌
许多研究调查了口腔溶血性链球菌同RAS以及BS之间的联系。有关于这方面的研究首先是通过观察BS患者出现链球菌引起的扁桃体炎和龋齿的发生率较高而进行的。此外,在BS患者中,各种链球菌抗原都可激发皮肤超敏反应并出现致炎细胞因子的PMBC产物增多。有假说提出,60~65KD的热休克蛋白(HsP)是链球菌和口腔上皮细胞之间的一种共同交叉反应性抗原。有趣的是,HsP65在多种细菌感染中皆可发挥免疫优势抗原(immuno-dominant antigen )作用。RAS和BS患者具有HsP65分支杆菌的血清抗体,并且HsP65反应性αβ和γδT细胞增加。针对HsP65分支杆菌的抗体与链球菌HsP有交叉反应,这表明二者有相同的抗原决定簇。因此,可以作出这样的假设,微生物HsP65刺激黏膜的郎格罕细胞,依次产生自身反应性T细胞群,后者主要针对口腔上皮细胞的内源性HsP60而发挥作用。
(3)幽门螺旋杆菌
自从发现了幽门螺旋杆菌在慢性胃炎和十二指肠溃疡中的作用之后,一些研究者开始探索此类细菌在RAS中的潜在作用。使用原位杂交方法,研究者发现29例口疮性溃疡患者的活检中有6例存在幽门螺旋杆菌的DNA。另外有研究表明,13例口疮性溃疡患者中11例出现了幽门螺旋杆菌的DNA。此外,将RAS患者同没有口腔黏膜疾病的患者以及健康对照者相比较,针对幽门螺旋菌的血清IgG反应的发生率并没有显著差异。一个试图在口疮性溃疡中分离和培养幽门螺旋杆菌的研究也没有获得成功。
许多研究者都提出这样的假设:对于慢性胃炎的患者而言,口腔可能是幽门螺旋杆菌的居留场所。这些研究中大多着重于牙菌斑,这是因为牙菌斑里含有大量尿素酶阳性的细菌微生物的缘故。然而,十分敏感的DNA检测手段和及其优良 细菌培养方法均不能证实牙菌斑或唾液中存在幽门螺旋杆菌。
(4)食物的超敏性
某些食物制品和调味/调色品以及防腐剂都可能诱发RAS。

不过,除了GSE之外,食物同RAS之间的因果关系并没有得到确切的证实。GSE患者进食含有谷胶的食物时会出现口腔溃疡。在一些病人中将这些物质从食物中去除,可使RAS得以好转。
(5)牙膏的影响
大多数牙膏都包含有十二烷硫酸钠阴离子清洁剂(SLS),后者约占牙膏总含量的1~3%。SLS的变性作用可清除保护性黏膜层,导致浅表的上皮细胞脱落以及黏膜对水溶性和脂溶性分子的渗透性增强。因此,使用含有SLS的牙膏可以促使内源性致溃疡的抗原得以聚集。使用含有SLS牙膏的RAS患者发生溃疡的次数要比使用不含SLS牙膏的患者远为更多。
(6)局部外伤
牙刷、洁牙线、口香糖、坚果、糖果或其他具有锐利表面的食物、坏牙修补术、局部注射止痛药以及牙科治疗等偶尔引起的局部外伤都可以导致口疮性溃疡的发生。中国人食用炒花生、炒瓜子、核桃仁等食品时极易发生口疮性溃疡,在祖国传统医学中被称之为“上火”。在正常患者中,继发于偶发性外伤性口腔黏膜损伤可以通过一系列体内平衡(内环境稳定)修补机制得以迅速愈合,其中包括黏膜组织和局部的免疫反应。相反的是,RAS患者的偶发性外伤通过免疫介导的组织损伤作用可引起溃疡形成。这种现象已通过采用缝合线诱发性黏膜创伤方法进行试验而得到证实。这些RAS患者在接受这种实验后24小时内可以发生溃疡,而对照组中仅出现轻微的炎症反应。
(7)戒烟
一些研究发现在吸烟者中口疮性溃疡的发病率要明显低于不吸烟者。实际上,戒烟者在戒烟之后,口腔溃疡的发生率增高,严重性增大。一些报道提出假设,吸烟引起上皮角质化增重,从而免于发生溃疡。然而,其他一些研究表明,对于不吸烟者不使用烟叶而使用尼古丁治疗口疮性溃疡可有相似的疗效,这表明尼古丁有重要的作用。尼古丁抑制了外周血中单个核细胞中的IL-2和和肿瘤坏死因子产生。因此,这就表明尼古丁可通过调节细胞因子产生而得以抑制口疮性溃疡的发生。
(8)维生素和矿物质的缺乏
3~18%的RAS患者可出现一种或多种以下物质的缺乏:维生素B1,B2,B6,B12,叶酸和铁。此外,一例RAS的病例是由缺锌所致,并且通过补锌后病情有明显好转。RAS和营养物质缺乏之间的相关性可能与地理或种族因素有关。大多数研究表明,这种相关性起源于欧洲或中东地区,然而美国的一个研究结果则完全相反。也有可能这些物质的缺乏是患者由于大型或疼痛性口腔溃疡而导致营养物质摄入不足引起的,或者是由原本存在的一种不良饮食习惯造成的。
