
近年来,国际上一些大样本量的临床长期随访研究发现,保留肾单位的肾部分切除术与根治性肾切除术相比对于小肾癌的肿瘤学疗效相似,而对于患者的长期生存更有益。因此,目前国内外较大型的医学中心对于局限性肾癌的治疗方式逐步倾向于保留肾单位的肾部分切除术。但对于不同的肾肿瘤,进行肾部分切除术时肿瘤的显露、完整切除以及肾实质、肾盂的重建的难度也有很大的不同。因此术前制订完善的手术计划十分重要,而这主要依赖于手术者根据影像学资料,对肾脏和肿瘤解剖进行细致深入的分析和判断。CT是目前肾脏肿瘤评估的金标准,它能评价血管、肾脏、肿瘤解剖结构,为术前计划的制订提供依据。随着2009年第一个肾脏肿瘤评分系统RENAL肾脏肿瘤评分系统出现以来,已经陆续有很多基于CT的肾脏肿瘤评分系统出现,这些评分系统都采用一种量化的方式描述肿瘤的解剖学特征。本文就目前国际上报道的10个肾脏肿瘤评分系统进行综述,并总结分析一些需要手术者在术前计划中需要注意的一些重要的解剖学特征。
1 现有的10种肾脏肿瘤评分系统
1.1 R.E.N.A.L评分系统
Kutikov和Uzzo于2009年首先提出了一个标准化的肾脏肿瘤评分系统,即R.E.N.A.L评分系统(见表1),该系统基于5个相关的解剖学特征,能够在CT和MRI图像基础上对肾脏肿瘤显著的解剖结构进行量化[1]。总得分是由各个方面的得分组成。R.E.N.A.L的缩写指代为(R)adius肿瘤大小是任何平面(轴向,矢状面,冠状面)肿瘤的最大直径,评分标准与肾脏肿瘤TNM分期类似;(E)xophytic/endophytic外凸率;(N)earness指肿瘤与肾窦和集合系统的接近程度,指肿瘤最深处接近集合系统或肾窦部的程度,得分也依据TNM分期,以mm为单位;(A)nterior/posterior指肿瘤位于肾脏腹侧或背侧,是唯一一个不以分数表示的一项,该项特征通过A(腹侧),P(背侧)和X(无法定义)三个描述符号来描述,此外另外一个符号H代表肾门的肿瘤;(L)ocation指肿瘤位于肾脏纵轴的关系。对上述每一项进行量化评分,每项得分按首字母缩写的顺序相加得到总分(例如,2+2+1+A+2=7A)。肾脏肿瘤评分得分为4、5、6的病变被认为低度复杂性,7、8、9的肿瘤被认为中度复杂性,10、11、12的被认为是高度复杂性。除了人为计算总得分以外,也可通过在线测量工具计算RENAL得分(www.nephrometry.com)。Kutikov和Uzzo运用RENAL系统回顾性地量化了50个肾脏肿瘤病例,并且得出结论:RENAL得分较低的(总分4~6以及总分7~9)的肿瘤病例在行肾部分切除术时更多是使用侵害性较小的手术方式,得分高达10~12分的患者更多接受了腹腔镜下肾切除根治术或者开放性肾部分切除术的手术方式。同时,从这些患者的预后数据得出结论,高RENAL得分的肾脏肿瘤明显与主要并发症的发生(21.9%)有关,中等(11.1%)或者低等(6.4%)(P=0.009)[2]。在Cleveland临床中心的研究也支持RENAL得分和热缺血时间高度相关(Spearman相关系数=0.54;P<0.001),随着肿瘤复杂性的增加热缺血时间也有上升的趋势(P 趋势<0.0001)[3]。
表1 R.E.N.A.L评分系统
缩写指代 | 评分 | ||
1 | 2 | 3 | |
(R)肿瘤大小/cm | ≤4 | >4~<7 | ≥7 |
(E)肿瘤外凸率 | ≥50% | <50% | 完全内生肿瘤 |
(N)肿瘤距集合系统/mm | >7 | 4~7 | <4 |
(AP)肿瘤位于肾腹侧或背侧 | 直接标注为A(腹侧),P(背侧),X(位置不明确) | ||
(L)肿瘤与肾上下极关系 | 肿瘤完全位于肾上极或下极 | 肿瘤大部分位于肾上极或下极 | 肿瘤50%以上穿过肾上极或下极 |
1.2 PADUA评分系统
另一个广泛使用的肾脏肿瘤评分系统是PADUA评分系统(preoperative aspects and dimensions used for an anatomical ),该系统评估肿瘤解剖结构复杂性(见表2),其综合了肿瘤直径大小及其它6个重要的解剖学特征,包括:(1)前后位置;(2)纵向位置;(3)边缘位置;(4)与肾窦的关系;(5)与集合系统的关系;(6)肿瘤深入肾实质的程度。该系统是由来自Padua大学的Ficarra等人[4]在2009年提出的,上述7项特征每项赋予一个介于1~3分的分数,再相加计算总得分。肾脏肿瘤PADUA得分在6~7、8~9、10~14分别为低、中、高度复杂性病变,同时在总得分后面增加一个“A”或者“P”作为后缀,以描述瘤体的位置。在最初的研究队列中发现PADUA得分能够作为所有并发症发生的预测因子。一个中、高PADUA得分(8~9和10~14)与低得分(6~7)相比,并发症发生的危险性更高,分别升高14倍和30倍[4]。一个对PADUA得分系统的验证试验也得出了一个结论,PADUA得分≥8的患者与那些PADUA得分<8的患者相比并发症发生率约增加20倍(HR=19.82;95%可信区间,,1.79~28.35;P=0.015)[5]。中国的数据也得出类似的结论,在开放肾部分切除手术中高PADUA得分提示更长的手术时间(P=0.007)、热缺血时间(P=0.001),以及更严重的失血(P=0.003)[6]。
表2 PADUA评分系统
解剖学特点 | PADUA评分 | ||
1分 | 2分 | 3分 | |
纵向位置 | 上/下极 | 中部 | — |
内外侧 | 外侧 | 内侧 | — |
与肾窦关系 | 无关 | 有关 | — |
与集合系统关系 | 无关 | 有关 | — |
外凸率 | ≥50% | <50% | 完全内陷 |
肿瘤直径 | ≤4.0 | 4.1~7.0 | >7.0 |
1.3 C指数
向心性指数(C-INDEX)是由Simmons等人[7]在2010年提出的一个量化肾脏肿瘤向心性的方法。在一些基础的概念中肿瘤大小和肿瘤向心性是2个决定手术困难性的因素。CI评分首先确定中心层面、纵轴及圆心:术前肾脏动态增强CT检查,扫描层厚为5mm,在连续均匀横断面肾脏CT中,取肾脏上、下缘层面图像序列数,上下两层面的序列数相加后取平均值,该值所在水平面即为肾脏中心层面;紧接着在此层面沿肾脏影像边缘画椭圆,椭圆圆心即为肾脏平面中心,肾脏纵轴垂直穿过圆心。肿瘤最大直径所在平面为肿瘤中心层面。随后进行数据测量:X表示肿瘤中心至肾脏纵轴的距离;平行于X测量肿瘤最大直径d(r=d/2);Y表示肿瘤中心至肾脏中心层面的距离;c表示肿瘤中心到肾脏中心的距离,利用勾股定理,则c= 。最后计算CI,通过肿瘤中心和肾脏中心的距离(c)以及肿瘤半径(r)大小来计算,CI=c/r(见图1)。CI为0时相当与肿瘤与肾脏中心同轴;CI<1相当与有一部分肿瘤叠加在肾脏中心;ci=1相当于肿瘤实质刚接触到肾脏中心。与此同时随着ci的增长,肿瘤越来越远离肾脏中心[7]。因此,ci越高,肿瘤向心性侵犯越少,并且肾单位保留手术与ci值较低时的肾单位保留手术相比更为灵活,与肿瘤位置有关的并发症发生机会也越少[8]。在最初的研究中,ci<2的肿瘤病例其缺血和手术时间趋向于变长,估计的失血也更多。作为一个肾脏肿瘤向心性的测量值,ci有量化,可重复性,观察者间差异仅为7%左右的优势[7]。肿瘤叠加在肾脏中心;ci=1相当于肿瘤实质刚接触到肾脏中心。与此同时随着ci的增长,肿瘤越来越远离肾脏中心[7]。因此,ci越高,肿瘤向心性侵犯越少,并且肾单位保留手术与ci值较低时的肾单位保留手术相比更为灵活,与肿瘤位置有关的并发症发生机会也越少[8]。在最初的研究中,ci<2的肿瘤病例其缺血和手术时间趋向于变长,估计的失血也更多。作为一个肾脏肿瘤向心性的测量值,ci有量化,可重复性,观察者间差异仅为7%左右的优势[7]。肿瘤叠加在肾脏中心;ci=1相当于肿瘤实质刚接触到肾脏中心。与此同时随着ci的增长,肿瘤越来越远离肾脏中心[7]。因此,ci越高,肿瘤向心性侵犯越少,并且肾单位保留手术与ci值较低时的肾单位保留手术相比更为灵活,与肿瘤位置有关的并发症发生机会也越少[8]。在最初的研究中,ci<2的肿瘤病例其缺血和手术时间趋向于变长,估计的失血也更多。作为一个肾脏肿瘤向心性的测量值,ci有量化,可重复性,观察者间差异仅为7%左右的优势[7]。肿瘤叠加在肾脏中心;ci=1相当于肿瘤实质刚接触到肾脏中心。与此同时随着ci的增长,肿瘤越来越远离肾脏中心[7]。因此,ci越高,肿瘤向心性侵犯越少,并且肾单位保留手术与ci值较低时的肾单位保留手术相比更为灵活,与肿瘤位置有关的并发症发生机会也越少[8]。在最初的研究中,ci<2的肿瘤病例其缺血和手术时间趋向于变长,估计的失血也更多。作为一个肾脏肿瘤向心性的测量值,ci有量化,可重复性,观察者间差异仅为7%左右的优势[7]。肿瘤叠加在肾脏中心;ci=1相当于肿瘤实质刚接触到肾脏中心。与此同时随着ci的增长,肿瘤越来越远离肾脏中心[7]。因此,ci越高,肿瘤向心性侵犯越少,并且肾单位保留手术与ci值较低时的肾单位保留手术相比更为灵活,与肿瘤位置有关的并发症发生机会也越少[8]。在最初的研究中,ci<2的肿瘤病例其缺血和手术时间趋向于变长,估计的失血也更多。作为一个肾脏肿瘤向心性的测量值,ci有量化,可重复性,观察者间差异仅为7%左右的优势[7]。肿瘤叠加在肾脏中心;ci=1相当于肿瘤实质刚接触到肾脏中心。与此同时随着ci的增长,肿瘤越来越远离肾脏中心[7]。因此,ci越高,肿瘤向心性侵犯越少,并且肾单位保留手术与ci值较低时的肾单位保留手术相比更为灵活,与肿瘤位置有关的并发症发生机会也越少[8]。在最初的研究中,ci<2的肿瘤病例其缺血和手术时间趋向于变长,估计的失血也更多。作为一个肾脏肿瘤向心性的测量值,ci有量化,可重复性,观察者间差异仅为7%左右的优势[7]。肿瘤叠加在肾脏中心;ci=1相当于肿瘤实质刚接触到肾脏中心。与此同时随着ci的增长,肿瘤越来越远离肾脏中心[7]。因此,ci越高,肿瘤向心性侵犯越少,并且肾单位保留手术与ci值较低时的肾单位保留手术相比更为灵活,与肿瘤位置有关的并发症发生机会也越少[8]。在最初的研究中,ci<2的肿瘤病例其缺血和手术时间趋向于变长,估计的失血也更多。作为一个肾脏肿瘤向心性的测量值,ci有量化,可重复性,观察者间差异仅为7%左右的优势[7]。肿瘤叠加在肾脏中心;ci=1相当于肿瘤实质刚接触到肾脏中心。与此同时随着ci的增长,肿瘤越来越远离肾脏中心[7]。因此,ci越高,肿瘤向心性侵犯越少,并且肾单位保留手术与ci值较低时的肾单位保留手术相比更为灵活,与肿瘤位置有关的并发症发生机会也越少[8]。在最初的研究中,ci<2的肿瘤病例其缺血和手术时间趋向于变长,估计的失血也更多。作为一个肾脏肿瘤向心性的测量值,ci有量化,可重复性,观察者间差异仅为7%左右的优势[7]。肿瘤叠加在肾脏中心;ci=1相当于肿瘤实质刚接触到肾脏中心。与此同时随着ci的增长,肿瘤越来越远离肾脏中心[7]。因此,ci越高,肿瘤向心性侵犯越少,并且肾单位保留手术与ci值较低时的肾单位保留手术相比更为灵活,与肿瘤位置有关的并发症发生机会也越少[8]。在最初的研究中,ci<2的肿瘤病例其缺血和手术时间趋向于变长,估计的失血也更多。作为一个肾脏肿瘤向心性的测量值,ci有量化,可重复性,观察者间差异仅为7%左右的优势[7]。肿瘤叠加在肾脏中心;ci=1相当于肿瘤实质刚接触到肾脏中心。与此同时随着ci的增长,肿瘤越来越远离肾脏中心[7]。因此,ci越高,肿瘤向心性侵犯越少,并且肾单位保留手术与ci值较低时的肾单位保留手术相比更为灵活,与肿瘤位置有关的并发症发生机会也越少[8]。在最初的研究中,ci<2的肿瘤病例其缺血和手术时间趋向于变长,估计的失血也更多。作为一个肾脏肿瘤向心性的测量值,ci有量化,可重复性,观察者间差异仅为7%左右的优势[7]。肿瘤叠加在肾脏中心;ci=1相当于肿瘤实质刚接触到肾脏中心。与此同时随着ci的增长,肿瘤越来越远离肾脏中心[7]。因此,ci越高,肿瘤向心性侵犯越少,并且肾单位保留手术与ci值较低时的肾单位保留手术相比更为灵活,与肿瘤位置有关的并发症发生机会也越少[8]。在最初的研究中,ci<2的肿瘤病例其缺血和手术时间趋向于变长,估计的失血也更多。作为一个肾脏肿瘤向心性的测量值,ci有量化,可重复性,观察者间差异仅为7%左右的优势[7]。肿瘤叠加在肾脏中心;ci=1相当于肿瘤实质刚接触到肾脏中心。与此同时随着ci的增长,肿瘤越来越远离肾脏中心[7]。因此,ci越高,肿瘤向心性侵犯越少,并且肾单位保留手术与ci值较低时的肾单位保留手术相比更为灵活,与肿瘤位置有关的并发症发生机会也越少[8]。在最初的研究中,ci<2的肿瘤病例其缺血和手术时间趋向于变长,估计的失血也更多。作为一个肾脏肿瘤向心性的测量值,ci有量化,可重复性,观察者间差异仅为7%左右的优势[7]。肿瘤叠加在肾脏中心;ci=1相当于肿瘤实质刚接触到肾脏中心。与此同时随着ci的增长,肿瘤越来越远离肾脏中心[7]。因此,ci越高,肿瘤向心性侵犯越少,并且肾单位保留手术与ci值较低时的肾单位保留手术相比更为灵活,与肿瘤位置有关的并发症发生机会也越少[8]。在最初的研究中,ci<2的肿瘤病例其缺血和手术时间趋向于变长,估计的失血也更多。作为一个肾脏肿瘤向心性的测量值,ci有量化,可重复性,观察者间差异仅为7%左右的优势[7]。肿瘤叠加在肾脏中心;ci=1相当于肿瘤实质刚接触到肾脏中心。与此同时随着ci的增长,肿瘤越来越远离肾脏中心[7]。因此,ci越高,肿瘤向心性侵犯越少,并且肾单位保留手术与ci值较低时的肾单位保留手术相比更为灵活,与肿瘤位置有关的并发症发生机会也越少[8]。在最初的研究中,ci<2的肿瘤病例其缺血和手术时间趋向于变长,估计的失血也更多。作为一个肾脏肿瘤向心性的测量值,ci有量化,可重复性,观察者间差异仅为7%左右的优势[7]。肿瘤叠加在肾脏中心;ci=1相当于肿瘤实质刚接触到肾脏中心。与此同时随着ci的增长,肿瘤越来越远离肾脏中心[7]。因此,ci越高,肿瘤向心性侵犯越少,并且肾单位保留手术与ci值较低时的肾单位保留手术相比更为灵活,与肿瘤位置有关的并发症发生机会也越少[8]。在最初的研究中,ci<2的肿瘤病例其缺血和手术时间趋向于变长,估计的失血也更多。作为一个肾脏肿瘤向心性的测量值,ci有量化,可重复性,观察者间差异仅为7%左右的优势[7]。肿瘤叠加在肾脏中心;ci=1相当于肿瘤实质刚接触到肾脏中心。与此同时随着ci的增长,肿瘤越来越远离肾脏中心[7]。因此,ci越高,肿瘤向心性侵犯越少,并且肾单位保留手术与ci值较低时的肾单位保留手术相比更为灵活,与肿瘤位置有关的并发症发生机会也越少[8]。在最初的研究中,ci<2的肿瘤病例其缺血和手术时间趋向于变长,估计的失血也更多。作为一个肾脏肿瘤向心性的测量值,ci有量化,可重复性,观察者间差异仅为7%左右的优势[7]。
。最后计算CI,通过肿瘤中心和肾脏中心的距离(c)以及肿瘤半径(r)大小来计算,CI=c/r(见图1)。CI为0时相当与肿瘤与肾脏中心同轴;CI<1相当与有一部分肿瘤叠加在肾脏中心;ci=1相当于肿瘤实质刚接触到肾脏中心。与此同时随着ci的增长,肿瘤越来越远离肾脏中心[7]。因此,ci越高,肿瘤向心性侵犯越少,并且肾单位保留手术与ci值较低时的肾单位保留手术相比更为灵活,与肿瘤位置有关的并发症发生机会也越少[8]。在最初的研究中,ci<2的肿瘤病例其缺血和手术时间趋向于变长,估计的失血也更多。作为一个肾脏肿瘤向心性的测量值,ci有量化,可重复性,观察者间差异仅为7%左右的优势[7]。肿瘤叠加在肾脏中心;ci=1相当于肿瘤实质刚接触到肾脏中心。与此同时随着ci的增长,肿瘤越来越远离肾脏中心[7]。因此,ci越高,肿瘤向心性侵犯越少,并且肾单位保留手术与ci值较低时的肾单位保留手术相比更为灵活,与肿瘤位置有关的并发症发生机会也越少[8]。在最初的研究中,ci<2的肿瘤病例其缺血和手术时间趋向于变长,估计的失血也更多。作为一个肾脏肿瘤向心性的测量值,ci有量化,可重复性,观察者间差异仅为7%左右的优势[7]。肿瘤叠加在肾脏中心;ci=1相当于肿瘤实质刚接触到肾脏中心。与此同时随着ci的增长,肿瘤越来越远离肾脏中心[7]。因此,ci越高,肿瘤向心性侵犯越少,并且肾单位保留手术与ci值较低时的肾单位保留手术相比更为灵活,与肿瘤位置有关的并发症发生机会也越少[8]。在最初的研究中,ci<2的肿瘤病例其缺血和手术时间趋向于变长,估计的失血也更多。作为一个肾脏肿瘤向心性的测量值,ci有量化,可重复性,观察者间差异仅为7%左右的优势[7]。肿瘤叠加在肾脏中心;ci=1相当于肿瘤实质刚接触到肾脏中心。与此同时随着ci的增长,肿瘤越来越远离肾脏中心[7]。因此,ci越高,肿瘤向心性侵犯越少,并且肾单位保留手术与ci值较低时的肾单位保留手术相比更为灵活,与肿瘤位置有关的并发症发生机会也越少[8]。在最初的研究中,ci<2的肿瘤病例其缺血和手术时间趋向于变长,估计的失血也更多。作为一个肾脏肿瘤向心性的测量值,ci有量化,可重复性,观察者间差异仅为7%左右的优势[7]。肿瘤叠加在肾脏中心;ci=1相当于肿瘤实质刚接触到肾脏中心。与此同时随着ci的增长,肿瘤越来越远离肾脏中心[7]。因此,ci越高,肿瘤向心性侵犯越少,并且肾单位保留手术与ci值较低时的肾单位保留手术相比更为灵活,与肿瘤位置有关的并发症发生机会也越少[8]。在最初的研究中,ci<2的肿瘤病例其缺血和手术时间趋向于变长,估计的失血也更多。作为一个肾脏肿瘤向心性的测量值,ci有量化,可重复性,观察者间差异仅为7%左右的优势[7]。肿瘤叠加在肾脏中心;ci=1相当于肿瘤实质刚接触到肾脏中心。与此同时随着ci的增长,肿瘤越来越远离肾脏中心[7]。因此,ci越高,肿瘤向心性侵犯越少,并且肾单位保留手术与ci值较低时的肾单位保留手术相比更为灵活,与肿瘤位置有关的并发症发生机会也越少[8]。在最初的研究中,ci<2的肿瘤病例其缺血和手术时间趋向于变长,估计的失血也更多。作为一个肾脏肿瘤向心性的测量值,ci有量化,可重复性,观察者间差异仅为7%左右的优势[7]。肿瘤叠加在肾脏中心;ci=1相当于肿瘤实质刚接触到肾脏中心。与此同时随着ci的增长,肿瘤越来越远离肾脏中心[7]。因此,ci越高,肿瘤向心性侵犯越少,并且肾单位保留手术与ci值较低时的肾单位保留手术相比更为灵活,与肿瘤位置有关的并发症发生机会也越少[8]。在最初的研究中,ci<2的肿瘤病例其缺血和手术时间趋向于变长,估计的失血也更多。作为一个肾脏肿瘤向心性的测量值,ci有量化,可重复性,观察者间差异仅为7%左右的优势[7]。肿瘤叠加在肾脏中心;ci=1相当于肿瘤实质刚接触到肾脏中心。与此同时随着ci的增长,肿瘤越来越远离肾脏中心[7]。因此,ci越高,肿瘤向心性侵犯越少,并且肾单位保留手术与ci值较低时的肾单位保留手术相比更为灵活,与肿瘤位置有关的并发症发生机会也越少[8]。在最初的研究中,ci<2的肿瘤病例其缺血和手术时间趋向于变长,估计的失血也更多。作为一个肾脏肿瘤向心性的测量值,ci有量化,可重复性,观察者间差异仅为7%左右的优势[7]。肿瘤叠加在肾脏中心;ci=1相当于肿瘤实质刚接触到肾脏中心。与此同时随着ci的增长,肿瘤越来越远离肾脏中心[7]。因此,ci越高,肿瘤向心性侵犯越少,并且肾单位保留手术与ci值较低时的肾单位保留手术相比更为灵活,与肿瘤位置有关的并发症发生机会也越少[8]。在最初的研究中,ci<2的肿瘤病例其缺血和手术时间趋向于变长,估计的失血也更多。作为一个肾脏肿瘤向心性的测量值,ci有量化,可重复性,观察者间差异仅为7%左右的优势[7]。肿瘤叠加在肾脏中心;ci=1相当于肿瘤实质刚接触到肾脏中心。与此同时随着ci的增长,肿瘤越来越远离肾脏中心[7]。因此,ci越高,肿瘤向心性侵犯越少,并且肾单位保留手术与ci值较低时的肾单位保留手术相比更为灵活,与肿瘤位置有关的并发症发生机会也越少[8]。在最初的研究中,ci<2的肿瘤病例其缺血和手术时间趋向于变长,估计的失血也更多。作为一个肾脏肿瘤向心性的测量值,ci有量化,可重复性,观察者间差异仅为7%左右的优势[7]。肿瘤叠加在肾脏中心;ci=1相当于肿瘤实质刚接触到肾脏中心。与此同时随着ci的增长,肿瘤越来越远离肾脏中心[7]。因此,ci越高,肿瘤向心性侵犯越少,并且肾单位保留手术与ci值较低时的肾单位保留手术相比更为灵活,与肿瘤位置有关的并发症发生机会也越少[8]。在最初的研究中,ci<2的肿瘤病例其缺血和手术时间趋向于变长,估计的失血也更多。作为一个肾脏肿瘤向心性的测量值,ci有量化,可重复性,观察者间差异仅为7%左右的优势[7]。肿瘤叠加在肾脏中心;ci=1相当于肿瘤实质刚接触到肾脏中心。与此同时随着ci的增长,肿瘤越来越远离肾脏中心[7]。因此,ci越高,肿瘤向心性侵犯越少,并且肾单位保留手术与ci值较低时的肾单位保留手术相比更为灵活,与肿瘤位置有关的并发症发生机会也越少[8]。在最初的研究中,ci<2的肿瘤病例其缺血和手术时间趋向于变长,估计的失血也更多。作为一个肾脏肿瘤向心性的测量值,ci有量化,可重复性,观察者间差异仅为7%左右的优势[7]。肿瘤叠加在肾脏中心;ci=1相当于肿瘤实质刚接触到肾脏中心。与此同时随着ci的增长,肿瘤越来越远离肾脏中心[7]。因此,ci越高,肿瘤向心性侵犯越少,并且肾单位保留手术与ci值较低时的肾单位保留手术相比更为灵活,与肿瘤位置有关的并发症发生机会也越少[8]。在最初的研究中,ci<2的肿瘤病例其缺血和手术时间趋向于变长,估计的失血也更多。作为一个肾脏肿瘤向心性的测量值,ci有量化,可重复性,观察者间差异仅为7%左右的优势[7]。肿瘤叠加在肾脏中心;ci=1相当于肿瘤实质刚接触到肾脏中心。与此同时随着ci的增长,肿瘤越来越远离肾脏中心[7]。因此,ci越高,肿瘤向心性侵犯越少,并且肾单位保留手术与ci值较低时的肾单位保留手术相比更为灵活,与肿瘤位置有关的并发症发生机会也越少[8]。在最初的研究中,ci<2的肿瘤病例其缺血和手术时间趋向于变长,估计的失血也更多。作为一个肾脏肿瘤向心性的测量值,ci有量化,可重复性,观察者间差异仅为7%左右的优势[7]。肿瘤叠加在肾脏中心;ci=1相当于肿瘤实质刚接触到肾脏中心。与此同时随着ci的增长,肿瘤越来越远离肾脏中心[7]。因此,ci越高,肿瘤向心性侵犯越少,并且肾单位保留手术与ci值较低时的肾单位保留手术相比更为灵活,与肿瘤位置有关的并发症发生机会也越少[8]。在最初的研究中,ci<2的肿瘤病例其缺血和手术时间趋向于变长,估计的失血也更多。作为一个肾脏肿瘤向心性的测量值,ci有量化,可重复性,观察者间差异仅为7%左右的优势[7]。肿瘤叠加在肾脏中心;ci=1相当于肿瘤实质刚接触到肾脏中心。与此同时随着ci的增长,肿瘤越来越远离肾脏中心[7]。因此,ci越高,肿瘤向心性侵犯越少,并且肾单位保留手术与ci值较低时的肾单位保留手术相比更为灵活,与肿瘤位置有关的并发症发生机会也越少[8]。在最初的研究中,ci<2的肿瘤病例其缺血和手术时间趋向于变长,估计的失血也更多。作为一个肾脏肿瘤向心性的测量值,ci有量化,可重复性,观察者间差异仅为7%左右的优势[7]。
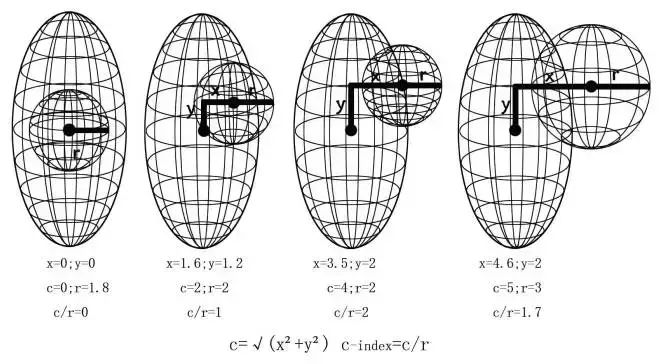
图1 CI评分基本原理
1.4 DAP评分系统
DAP评分系统是由Simmons等人[9]于2012年提出的,它综合充分利用了RENAL和C指数的属性。这个DAP肾脏评分(见图2)主要通过人为测量,使用基本的影像浏览软件而非复杂的电脑分析,因此用户界面更为友好,临床上使用也更为直观,具有测量误差少,表达特征良好,可解释性强等优点。DAP测量方法共有4个步骤。步骤一:选取肿瘤直径最大的平面作为测量平面,在此平面内根据肿瘤直径不同大小进行评分。<2.4cm为1分,2.4~4.4cm为2分,>4.4cm为3分。步骤二:在步骤一中所选取的平面内,沿肾脏边缘(非肿瘤边缘)画一个轮廓,在轮廓的中心定一个点,记录肿瘤边缘离该点的最短距离,对此距离进行评分。距离>1.5cm为1分,≤1.5cm为2分,肿瘤接触到或者覆盖这个点为3分。步骤三:通过取肾脏上下边缘所在影像层面的平均值来确定目标平面,将此平面设定为肾脏赤道平面。记录肿瘤边缘离此平面的距离,对该距离进行评分,>2cm为1分,≤2cm为2分,肿瘤边缘触及或超过此平面为3分。步骤四:将3个步骤的得分相加得出最终得分。最初的研究发现,DAP得分与肾部分切除术后肾脏体积减少、后期肾功能恢复有明显联系[9]。有一个研究比较了DAP评分系统和RENAL肾脏肿瘤评分系统,发现DAP受试者手术特征曲线下面积(0.897)比RENAL肾脏肿瘤评分系统受试者手术特征曲线面积(0.825)要好,更利于决定是否实施腹腔镜下肾脏部分切除术[10]。
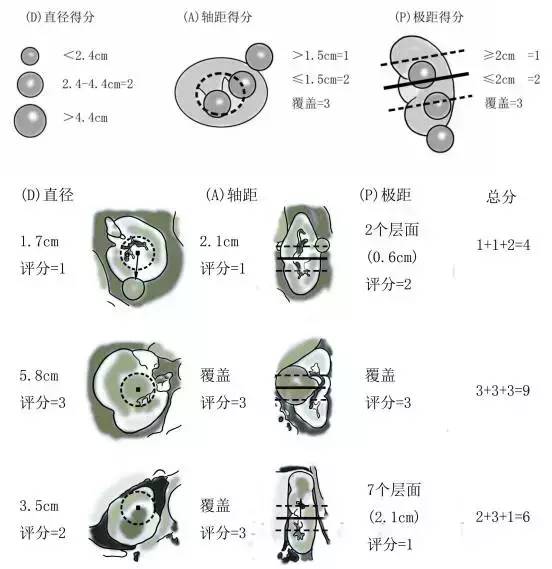
图2 DAP肾脏评分系统