
前言:人体之所以能在出血时快速止血,又能保证血液正常流动,是因为体内存在着复杂精密的凝血-抗凝、纤溶-抗纤溶机制,它们保持着动态平衡,其中任何一个机制受到破坏都可能导致出血或血栓性疾病。如果把血液凝固比作一场可能失控的“火灾”,那么抗凝血酶就是时刻待命的“消防员”。
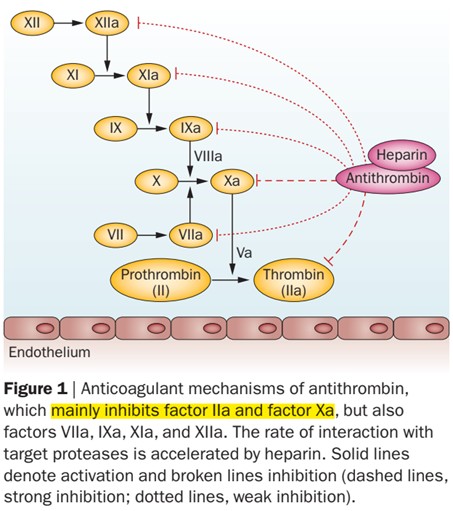
抗凝血酶(AT),也被称为抗凝血酶III(AT-III),主要由肝脏合成,是一种丝氨酸蛋白酶抑制剂,能通过抑制凝血途径中的丝氨酸蛋白酶的活性而发挥抗凝作用,是人体最重要的生理性抗凝因子。如果这位“消防员”偷懒(活性降低),可能引发致命的血栓危机!凝血过程中活化的凝血因子,除了Va和VⅢa(Va和VⅢa不属于丝氨酸蛋白酶),其余因子(包括IIa、VIIa、Ⅸa、Ⅹa、Ⅺa、Ⅻa因子)均能不同程度的被AT抑制,尤其是凝血瀑布的核心——活化的X因子(Xa)和凝血酶(IIa)。AT的抗凝作用占到了抗凝系统的70%左右,是当之无愧的“灭火队队长”。
AT抗凝机制示意图:
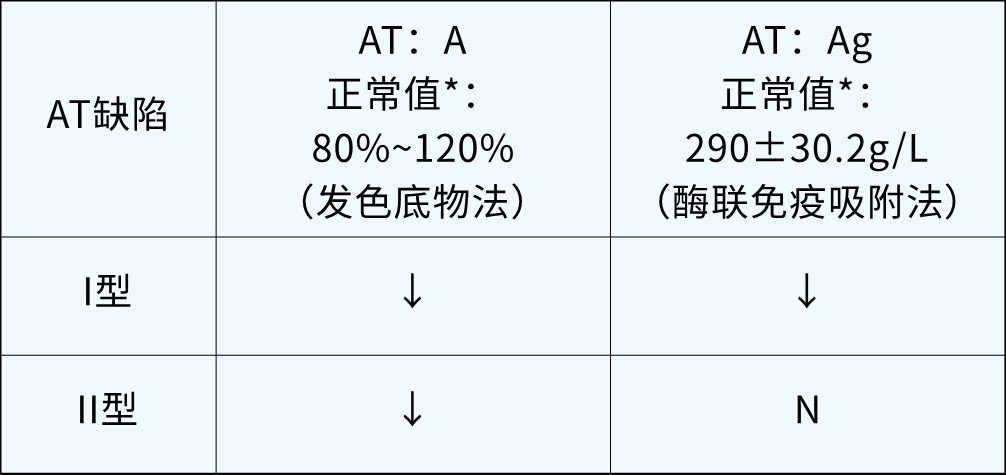
AT检测包括AT活性(antithrombin activity,AT∶A)检测和AT抗原(antithrombin antigen,AT:Ag)检测,抗原检测即含量检测。根据AT活性和抗原的检测结果,可将AT缺陷症分为I型和II型,其中I型缺陷指“量”的变化,体现在检测结果上为活性和抗原水平同时下降;II型缺陷仅指“质”的变化,体现在检测结果上为活性下降,抗原水平正常(见下表)。AT活性检测常用发色底物法,抗原检测常用酶联免疫吸附法。
AT缺陷症的分型:
目前国内临床开展的主要是AT活性检测。由于AT活性会受到一些获得性因素的影响而出现一过性降低,因此不可仅凭一次“异常”检测结果做出诊断,应在获得性因素控制稳定后,至少复测2次“异常”,每次检测间隔4~6周。
AT活性值的临床意义

重点推荐以下10类人群进行AT活性检测。
①特发性或复发性静脉血栓栓塞症(VTE)患者;
②年龄较轻(<40岁)时发生VTE者;
③有VTE家族史者(尤其是一级亲属较年轻时发生VTE);
④发生罕见部位(如,脑、肝、肠系膜或肾静脉)的VTE患者;
⑤新生儿发生内脏血栓、暴发性紫癜、皮肤出血性坏死;
⑥复发性流产患者;
⑦围产期或口服避孕药、雌激素替代治疗后发生血栓形成者;
⑧重症肝病者;
⑨需长期使用肝素抗凝治疗者及出现肝素抵抗者;
⑩使用门冬酰胺酶类药物(如左旋门冬酰胺酶、培门冬酶)的白血病/淋巴瘤/儿童急性淋巴细胞白血病(ALL)患者
根据AT缺陷的原因(遗传性或获得性)、是否合并VTE和VTE的高危因素(如,手术、妊娠、创伤等),提供以下管理策略,仅供参考。
01、遗传性AT缺陷者的管理
①预防性措施:对于无症状的AT缺陷者通常只需基础预防(如,避免久坐/久卧,合理运动,适量饮水/避免脱水),一般无需长期抗凝;但在妊娠、手术等高危时期需在医生的指导下进行短期预防性抗凝。
②替代治疗:AT浓缩剂:适用于急性血栓事件或围手术期,目标维持AT活性>80%。新鲜冰冻血浆(FFP):用于无法获取AT浓缩剂时,可短期提升AT水平。
③抗凝策略调整:
肝素:急性期首选,需监测抗Xa活性。当AT活性<50%时需联合输注AT浓缩剂或FFP,以补充AT。
华法林:长期预防血栓,维持INR 2.0-3.0,需注意出血风险。
动态监测:制定合适的监测频率,动态监测AT活性及凝血功能(PT/APTT)。
02、获得性AT缺陷者的管理
①对因(病因)治疗:
肝脏疾病:改善肝功能以恢复AT合成,必要时补充AT浓缩剂。
肾病综合征:控制蛋白尿,减少AT丢失,联合抗凝治疗。
②抗凝策略调整:
肝素抵抗处理:AT活性<50%时优先补充AT浓缩剂,而非增加肝素剂量。
长期抗凝适应症:危险因素持续存在者,可长期华法林/新型口服抗凝药(NOACs)治疗。
动态监测:制定合适的监测频率,动态监测AT活性及凝血功能(PT/APTT)
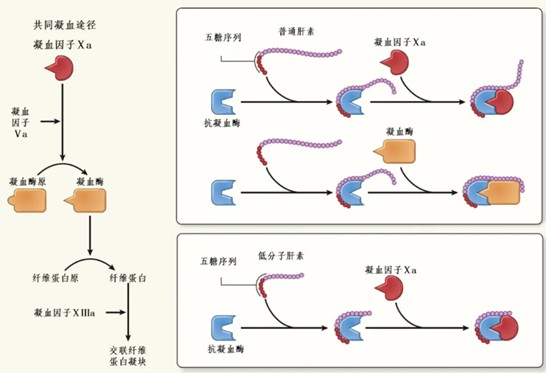
人体内AT单独的抗凝活性有限,但在与肝素结合后,其抗凝效应可提升上千倍。这是因为肝素有一个戊糖序列,能与AT高效结合,诱导AT构象改变,使AT的活性中心充分暴露,使AT更易与凝血因子(如IIa、Xa因子)结合,从而加速对这些因子的灭活。
肝素的抗凝机制:
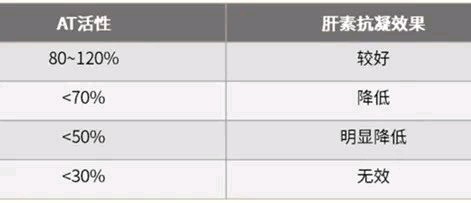
AT缺陷是导致肝素抵抗的重要原因,因此AT活性检测常用于预判肝素治疗效果/肝素抵抗寻因。
AT活性与肝素抗凝效果的关系:
AT活性检测是评估凝血功能、预防血栓、指导抗凝治疗的重要手段,其次也用于辅助诊断肝病(如肝硬化、肝炎)、肾病综合征、弥散性血管内凝血(DIC)等疾病。但由于AT活性检测受多因素干扰,且单次检测结果可能无法反映真实情况,因此常需结合临床背景和其他辅助检查综合分析,以规避误诊或漏诊风险。