
引言:认识胰腺囊实性肿瘤
胰腺囊实性肿瘤(Pancreatic Cystic and Solid Neoplasms)是一组异质性极强的病变,从完全良性的小囊肿到高度恶性的肿瘤均包含其中。随着医学影像技术的飞速发展,这类肿瘤的检出率呈现显著上升趋势——腹部MRI的检出率高达20%~49.1%,远高于CT检查的3%。这些肿瘤多数在体检中被偶然发现,却让无数患者陷入“是否罹患胰腺癌”的恐慌中。事实上,这类肿瘤包含多种亚型,其生物学行为差异巨大:有些可以安全观察数年,有些则需要立即手术干预。
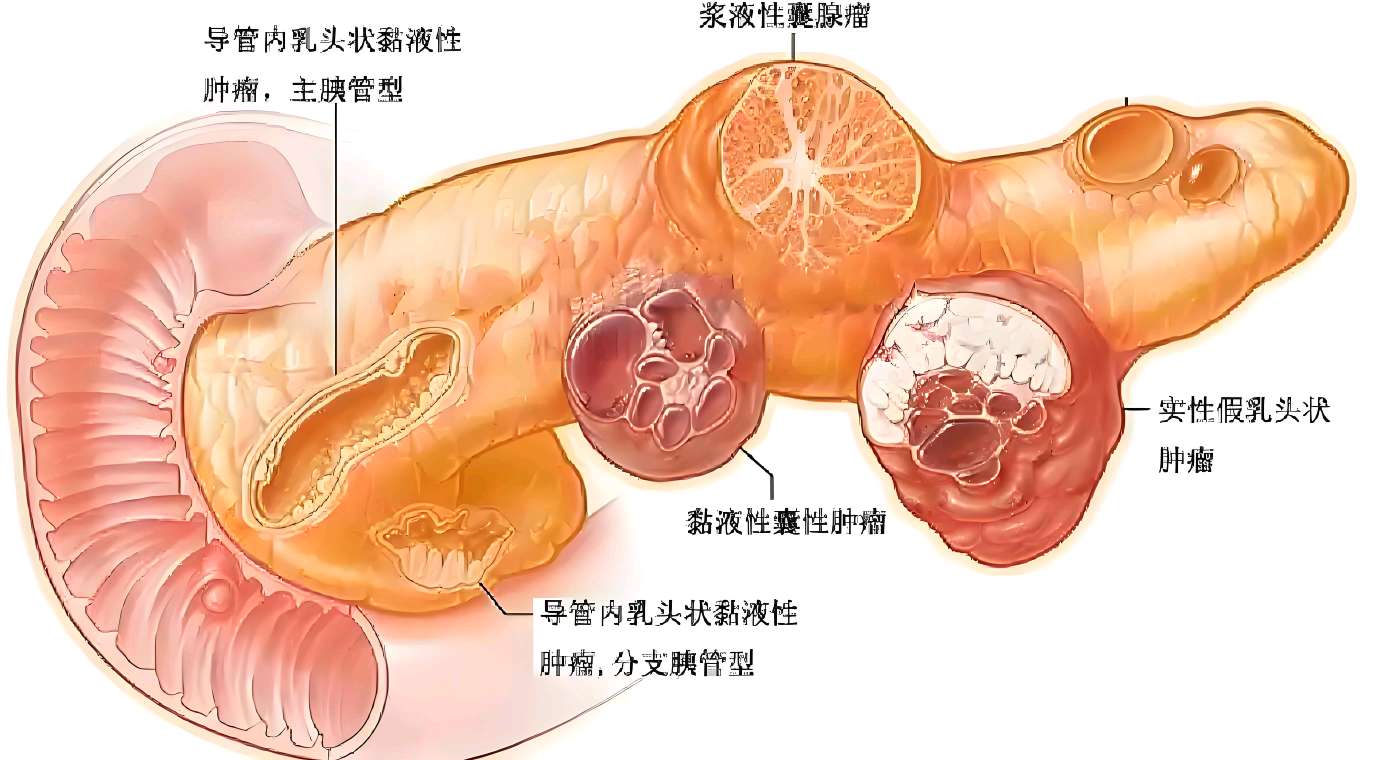
一、肿瘤分类与特征:认识四种主要类型
1 .实性假乳头状瘤(SPN):年轻女性的“女儿瘤”
典型特征:
①人群特点:占所有胰腺肿瘤的1%-2%,85%以上发生于年轻女性(平均年龄25岁),男女比例达1:8.4,因此被称为“女儿瘤”。
②病理表现:肿瘤通常体积较大(平均直径7-9cm),包膜完整,切面呈黄褐色,常见出血和囊性变区域。显微镜下可见肿瘤细胞围绕纤维血管轴心形成特征性假乳头结构。
③生物学行为:属于交界性肿瘤(低度恶性潜能),尽管85%为良性,但具有10%-15%的恶性潜能,术后有8%-20%的复发率。
2 .浆液性囊腺瘤(SCN):老年女性的“奶奶瘤”
核心特点:
①人群分布:80%见于60岁以上女性,故称“奶奶瘤”。
②病理亚型:分为微囊型(最常见,呈蜂窝状)、大囊型(单囊或寡囊)和混合型:
③微囊型:中央星状瘢痕伴钙化(30%病例),具有诊断特异性
③大囊型:无包膜和壁结节,易误诊为假囊肿
④恶性风险:恶变率低于1%,是唯一可安全随访的主要类型。
3. 黏液性囊性肿瘤(MCN):中年女性的“母亲瘤”
关键特征:
①高危人群:99.7%发生于中年女性(48-55岁),95%位于胰体尾部。
②癌变风险:属于明确癌前病变:
③粘液性囊腺瘤(良性,72%)
④交界性肿瘤(10.5%)
⑤原位癌(5.5%)
⑥浸润性癌(12%)
⑦影像标志:CT/MRI显示厚壁囊腔(>2mm)、蛋壳样钙化及强化壁结节(恶性征象)。
4 .导管内乳头状黏液性肿瘤(IPMN):老年男性的“爷爷瘤”
分型与风险:
①人群特点:70%发生于男性,平均年龄65岁,故称“爷爷瘤”。
②分型与恶变率:

③高危征象:壁结节≥5mm、主胰管扩张>10mm、梗阻性黄疸是绝对手术指征。
二、临床表现与诊断技术:从隐匿症状到精准判别
1、 临床表现:隐匿性与多样性并存
大多数胰腺囊实性肿瘤无症状(70%以上),常在体检时被偶然发现。当肿瘤增大或恶变时,可能出现:
①压迫症状:上腹不适、餐后饱胀感
②胰管梗阻:反复发作的急性胰腺炎(特别是IPMN)
③胆道梗阻:皮肤巩膜黄染(晚期恶性征象)
④腹部肿块:巨大SPN或MCN可触及包块
⑤非特异性症状:腰背部疼痛、体重下降
2 、诊断技术:多模态精准评估
现代医学采用阶梯式诊断策略,结合多种技术优势:
①首选检查:MRI联合MRCP
优势:对液体成分高度敏感,可清晰显示囊肿与胰管交通(IPMN特异性征象),无辐射暴露
价值:鉴别微囊型SCN(蜂窝状)、IPMN(葡萄串征)及SPN(出血信号)
②增强CT:评估手术可行性
可显示钙化模式(SCN中央钙化 vs MCN蛋壳样钙化)
评估肿瘤与周围血管关系(重要手术规划)
③内镜超声(EUS):高危征象精准评估
适应症:肿瘤≥3cm、壁结节>5mm、主胰管扩张>5mm等
进阶技术:
EUS-FNA:囊液分析(CEA、淀粉酶、葡萄糖)
EUS-TTNB:通过穿刺针获取组织,诊断效能显著优于FNA
CE-EUS:评估壁结节血供(恶性强化特征)
nCLE:激光共聚焦显微成像(新兴技术)
④液体活检与基因检测
囊液葡萄糖:鉴别黏液性囊肿(敏感度91%)优于CEA
KRAS/GNAS突变:对黏液性PCN诊断特异度达100%
二代测序(NGS):预测高级别异型增生(敏感度88%)
三、个体化治疗策略:从积极监测到根治性手术
1 、治疗原则:基于风险分层
手术决策需综合考量:肿瘤类型、大小、生长速度、影像高危征象、年龄及合并疾病
2 、各类肿瘤的管理策略
①SPN(实性假乳头状瘤):
推荐手术:即使无症状也应切除(交界性本质)
术式:局部切除(包膜完整者)或胰体尾切除术
②SCN(浆液性囊腺瘤):
首选监测:无压迫症状者可长期随访
手术指征:肿瘤≥6cm、生长迅速(>5mm/年)或压迫症状
③MCN(黏液性囊性肿瘤):
多数需手术:癌前病变本质
例外情况:<4cm、无壁结节、CA19-9
正常者可谨慎随访
④IPMN(导管内乳头状黏液性肿瘤):
绝对手术指征:黄疸、囊壁强化结节、主胰管≥10mm
相对指征:分支型IPMN>3cm、胰液细胞学高度异型
争议点:主胰管局部扩张<10mm可密切随访(恶变率仅3.8%)
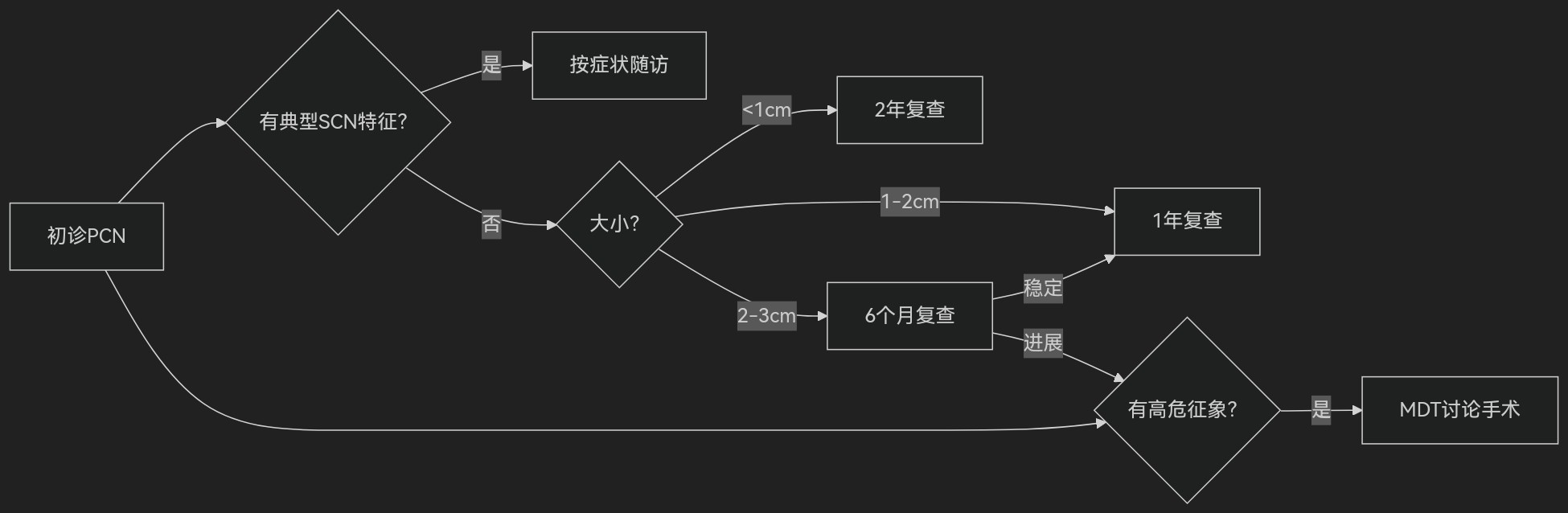
3 、随访方案:规范化与个体化结合
监测策略基于肿瘤类型与风险分层:
低风险(如SCN):每2-3年MRI复查(无症状小囊肿)。
中风险(分支型IPMN/MCN无危险因素):首年每6个月复查,稳定后每年1次
高风险(术后IPMN/携带高危征象未手术):每6个月MRI+EUS交替
中国2022指南推荐随访框架:
四、前沿进展与未来方向
1 、诊断技术创新
①人工智能辅助影像分析:深度学习模型在鉴别PCN类型上准确率已达89%,有望减少主观判断误差
②液体活检应用:
囊液甲基化标志物(如THBD、CDO1)可早期识别恶性转化
血液外泌体miRNA谱系分析(无创监测工具)
2、 微创手术进展
①腹腔镜/机器人技术:胰体尾切除术中应用率达70%,显著减少出血量、加速康复
②保留器官功能术式:
胰腺中段切除术(适于颈部肿瘤)
保留脾脏的胰体尾切除术(保护免疫功能)
3、 分子靶向治疗探索
①SPN靶向治疗:CTNNB1突变(>90%)激活Wnt通路,新型Wnt抑制剂处于I/II期试验
②IPMN免疫治疗:错配修复缺陷(dMMR)亚型对PD-1抑制剂敏感
结语:理性面对,科学管理
胰腺囊实性肿瘤的诊疗已步入精准医学时代。从“女儿瘤”(SPN)、“奶奶瘤”(SCN)到“爷爷瘤”(IPMN),每一类型均有其独特的生物学行为和临床管理策略。核心原则是:既不过度治疗良性病变(如微囊型SCN),也不遗漏高危病变(如主胰管型IPMN)的干预时机。随着MRI、EUS-FNA及分子诊断技术的进步,多学科协作(MDT)模式已成为制定个体化方案的金标准。患者应选择具备丰富胰腺疾病诊疗经验的医疗中心,在全面评估基础上,共同决策最适合的诊疗路径。