
“分化型甲状腺癌”是最常见的甲状腺癌类型,其规范化治疗通常包括三个步骤:外科手术治疗、碘131治疗和促甲状腺激素抑制治疗。促甲状腺激素(TSH)抑制治疗作为甲状腺癌术后的重要辅助治疗方法,可延长患者生存期,至今应用探索已有70年历史。
那么TSH抑制治疗如何发展和演变?
循证医学证据显示,TSH抑制治疗可降低分化型甲状腺癌患者肿瘤复发风险,延长生存时间。回顾指南演变过程,对于TSH抑制治疗的推荐逐渐趋向精细化,包括①初始复发风险分层概念的提出及细化、②放宽复发风险低危患者TSH抑制目标、③动态疗效与TSH抑制治疗副反应以及双风险评估随访理念的提出等,可以看出TSH抑制治疗与监测正在从是否达标并积极防治副反应,向个体化、精准化、动态评估的方向发展。
①初始复发风险分层概念的提出及细化:早期的甲状腺癌术后管理选择主要依赖于TNM分期,但TNM分期其价值在于预测死亡,可能错误估计一些患者的复发风险。2006年,美国甲状腺学会(ATA)指南首次提出明确的术后复发风险分层标准,根据临床病理特点、术中所见、治疗后131碘全身显像(RxWBS)结果将手术后的DTC病人分为低危、中危、高危。2009年,ATA指南沿用上述分层,并纳入颈部淋巴结转移、术后高Tg血症2个指标,首次提出根据复发风险分层制定初治期TSH抑制目标。2015年,ATA指南进一步细化分层,纳入转移淋巴结大小及数目、滤泡癌血管侵犯程度、基因分子学特征等指标。
②放宽复发风险低危者TSH抑制治疗目标:2006年ATA指南建议低危、高危病人TSH分别维持在0.1~0.5 mU/L和<0.1 mU/L;而2009年,ATA指南扩大了TSH抑制治疗的适用人群,建议低危和中或高危病人分别将TSH水平分别维持在0.1~0.5 mU/L和<0.1 mU/L。2015年ATA指南呼吁对缺乏高侵袭性证据的DTC病人TSH抑制治疗目标值较前有所放宽。复发风险低危、中危病人TSH目标分别放宽至0.1~2.0 mU/L、0.1~0.5 mU/L,复发风险高危病人TSH仍需严格控制在<0.1 mU/L。部分低危病人可将TSH控制目标放宽至正常低值范围(0.5~2.0 mU/L),即“相对抑制”水平。
③ 动态疗效与TSH抑制治疗副反应双风险评估随访理念的提出:长期随访过程中,DTC病人的转归并非一成不变,应根据临床病程、疗效和副反应不断修正初始复发危险分层,即动态疗效与TSH抑制治疗副反应双风险评估,通常在初始治疗6~18个月后开始评估。根据随访过程中获得的检查结果及时调整治疗方案是常规的临床思维,并非独特创新。因此2015年,ATA指南将治疗反应分为疗效满意、生化疗效不佳、疗效不确切、结构性疗效不佳4类。长期随访过程中,TSH抑制治疗目标应结合治疗反应的动态评估结果及副反应风险调整:对于疗效满意者,TSH可放宽至0.5~2.0 mU/L;对于结构性疗效不佳者,若无房颤,TSH仍应严格控制在<0.1 mU/L;对于生化疗效不佳、疗效不确切的病人,需要权衡副反应风险,大部分风险较低的病人可将TSH控制在0.1~0.5 mU/L。
表(1)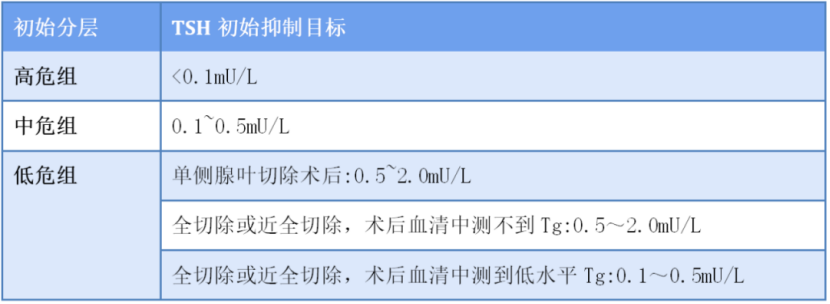
甲状腺癌初始复发危险度分层
(1)低危组,符合以下全部条件者:
· 所有肉眼可见的肿瘤均被彻底切除;
· 局部组织或结构无肿瘤侵犯;
· 无局部或远处转移;
· ≤ 5 个淋巴结转移(最大径 < 0.2 cm);
· 单灶或多灶的腺体内 PTMC(包括伴有 BRAFV600E 基因突变)。
(2)中危组,符合以下任一条件者:
· 可见肿瘤有甲状腺软组织侵犯;
· >5 个淋巴结转移 (最大径 < 3 cm);
· 血管侵犯;
· 腺体内 PTC,原发肿瘤直径在 1~4 cm, BRAFV600E 突变;
· 多灶的 PTMC 伴微小腺外侵犯和 BRAFV600E 突变。
(3)高危组,符合以下任一条件者:
· 肉眼可见肿瘤侵犯周围组织;
· 肿瘤未能完整切除,术中有残留;
· 远处转移;
· 任意转移淋巴结最大径 ≥ 3 cm;
· 滤泡状癌伴明显血管侵袭(> 4 个病灶)。
表(二)
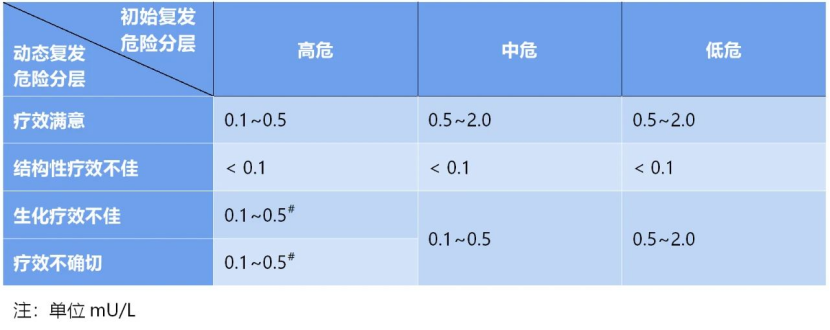
甲状腺癌动态复发危险分层
疗效满意:无结构异常 + 无生化病灶
影像学检查(彩超,CT,诊断醒全身核素显像(Dx-WBS),PETCT)无异常;
抑制性 Tg < 0.2ug/L 或刺激性 Tg<1ug/L,TgAb 阴性。
生化疗效不佳:结构正常 + 生化异常
影像学阴性;
抑制性 Tg>1ug/L 或刺激性 Tg>10ug/L 或 TgAb 持续增高。
结构性疗效不佳:结构异常
影像学阳性,无论 Tg 水平及 TgAg 阳性与否。
疗效不确切:无法判断是否有结构和生化病灶
影像学性质待定,抑制性 Tg<1ug/L,刺激性 Tg<10 ug/L,TgAb 稳定或下降。