
原创 中国实用外科杂志 2025年09月05日 13:48

通信作者:郑志鹏教授

陈雪芳
【引用本文】陈雪芳,张 彤,郑志鹏. 基于“六扇门”解剖的腹腔镜Glisson蒂横断式肝切除术[J]. 中国实用外科杂志,2025,45(8):908-911.
DOI:10.19538/j.cjps.issn1005-2208.2025.08.11
基于“六扇门”解剖的腹腔镜Glisson蒂横断式肝切除术
陈雪芳1,张 彤2,郑志鹏1
中国实用外科杂志,2025,45(8):908-911DOI:10.19538/j.cjps.issn1005-2208.2025.08.11
摘要 Takasaki在1988年提出Glisson蒂横断式肝切除术,即通过第一肝门鞘外解剖的方法,可以将目标肝蒂进行一并处理。2017年Sugioka结合对Laennec膜解剖的研究,进一步系统地阐述了经第一肝门鞘外解剖的入路,描述了通过解剖第一肝门的6个裂隙,可以获得相应目标肝蒂的阻断并完成Glisson蒂横断式肝切除术,并将这6个裂隙命名为“六扇门”。近年来,作者团队将“六扇门”解剖理念应用于临床实践,将6个“门”完整地进行系统的解剖和贯通,成功实施了相应的腹腔镜下Glisson蒂横断式肝切除术式,获得良好的临床效果。在此基础上,对“六扇门”解剖理论进一步拓展与完善,提出了“窗户”的概念对“门”进行定位,并对Sugioka的理论中未阐述的第一肝门潜在可利用的2个裂隙进行定义和命名,提出“第七扇门”和“第八扇门”,实现了左外叶和右后叶的段间Glisson蒂解剖。
基金项目:国家自然科学基金青年项目(No.82403176);广州市市校联合项目(No.SL2024A03J00592)作者单位:1广州医科大学附属第五医院肝胆胰外科,广东广州 510700;2厦门大学附属翔安医院普通外科、器官移植中心,福建厦门 361000通信作者:郑志鹏,E-mail:zhipeng1116@126.com
近年来,腹腔镜肝切除术(laparoscopic liver resection,LLR)逐步成为肝脏肿瘤治疗的主流方式[1-2]。解剖性肝切除术(anatomic liver resection,ALR)指完整切除解剖上相对独立的肝段或联合肝段,整块切除肿瘤及其可能荷瘤的门静脉流域[3]。腹腔镜下进行ALR的核心技术在于对Glisson蒂的处理,从而实现对目标肝段范围的界定。Glisson蒂的处理方法主要有两种:一是通过术中超声引导门静脉穿刺注射吲哚菁绿(indocyanine green,ICG)进行正向染色;二是通过解剖出目标肝蒂并对入肝血流进行阻断,从而获得缺血线或使用ICG进行反向染色。如何在腹腔镜下准确、迅速、安全地完成Glisson蒂的穿刺或解剖,仍然是肝脏外科医生面临的难题[4]。Glisson蒂的解剖方法主要分为鞘内解剖法和鞘外解剖法两种。早期开展ALR多采用鞘内解剖法,即通过打开Glisson鞘,将鞘内的肝动脉、门静脉分别解剖出来进行阻断。鞘内法操作繁杂、耗时较长,限制其在LLR中的应用,目前主要作为鞘外解剖法的补充方法。
Takasaki在1988年提出一种新的肝脏解剖分段法,将肝脏分为左肝、中肝和右肝三等份(相当于Couinaud分段的左半肝、右前叶和右后叶),并阐述了通过第一肝门肝外裂隙可以解剖并离断相应的左肝、右前和右后肝蒂的方法,即Glisson蒂横断式肝切除术[5]。Takasaki描述的鞘外解剖法更加简便省时,无须考虑鞘内管道的变异和走行,降低了误损伤的发生风险,是“六扇门”解剖的雏形。随着对肝脏精细解剖的认识不断深入,Laennec膜这一传统解剖概念被提出[6]。Laennec膜即附着在肝实质的膜性结构,又称为肝脏固有筋膜,其与Glisson鞘之间存在天然的解剖间隙。Sugioka等[7]在此基础上,进一步阐述了通过解剖第一肝门的6个裂隙可以获得相应目标肝蒂的阻断,并将这6个裂隙命名为“六扇门”(six gates)。“六扇门”是根据肝脏的特定解剖标志进行定位,通过鞘外解剖的方法可以打开相应位置的“门”,并将不同“门”进行贯通从而实现相应的Glisson蒂横断式肝切除术。笔者团队结合自身临床实践经验,明确了“门”的定义,即经第一肝门区域能够将肝实质与肝蒂分离,并获得目标肝段的Glisson蒂阻断的肝外裂隙。据此定义,第一肝门区域至少存在2个潜在未命名的“门”。
随着LLR技术的发展成熟,腹腔镜Glisson蒂横断式肝切除术已成为重要发展方向[8-10],笔者团队将“六扇门”解剖理论应用于腹腔镜Glisson蒂横断式肝切除术,积累了一定的经验[11]。本文将对“六扇门”的解剖基础、临床应用进行总结,并结合笔者团队的手术实践经验,将“六扇门”拓展补充至“八扇门”,以便丰富门的理论。
1 解剖学基础
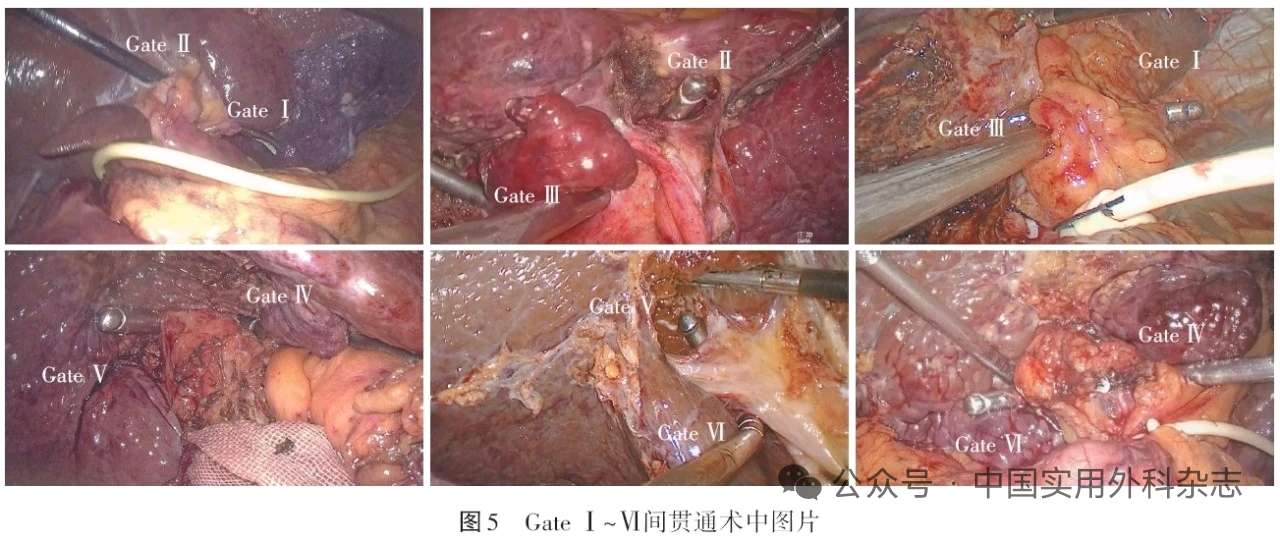
1.1 “六扇门”位置 GateⅠ,即Arantius板的尾端。GateⅡ,即肝圆韧带与脐板的连接处。GateⅢ,即左肝蒂脐部右侧缘的根部。GateⅣ,即胆囊板后缘或右前叶肝蒂的左侧缘。GateⅤ,即右肝蒂的分叉处。Gate Ⅵ,即右后肝蒂与尾状突支肝蒂(G1c)之间的间隙[7]。见图1(图1的绘制参考了文献[7])。
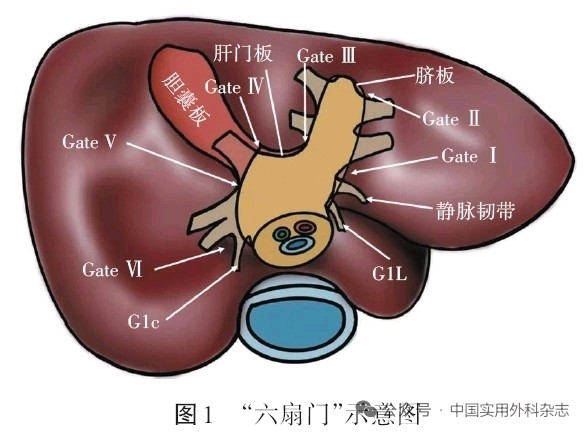
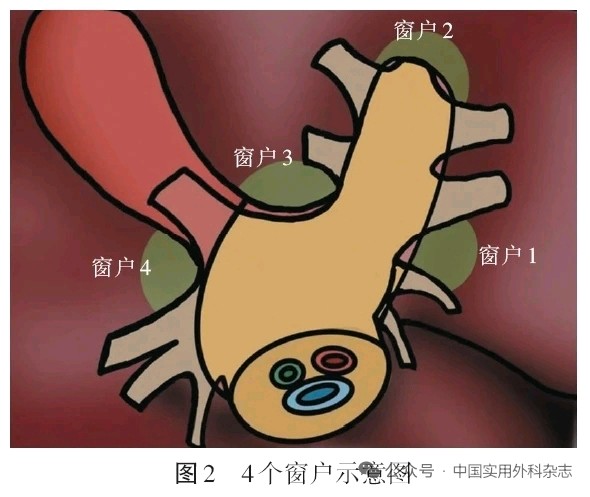
1.2 4个门板 包括胆囊板、肝门板、脐板和Arantius板。所谓门板,即在第一肝门区域Glisson蒂增厚的结缔组织,存在一定的厚度和韧度,在相应的门板周围进行解剖游离操作不容易引起Glisson蒂的破损和鞘内管道的损伤。下降门板可以获得相应“门”的入口,其中肝门板是最重要的门板,是通往各个“门”的中枢,通过充分下降肝门板,可以从这里贯通到所有其他的“门”。胆囊板入路则是通过将胆囊板与覆盖在胆囊床肝实质的Laennec膜分离,可以快速显露右前叶Glisson蒂[12];下降脐板,可以经此贯通至左侧肝蒂的各个“门”。见图1。1.3 4个窗户 在下降门板的过程中,需要将门板周围的肝实质分开,这一动作类似推开一扇窗户。笔者将围绕在肝门板周围的肝实质定义为“窗户”。根据4个门板所在的位置,笔者定义了4个窗户:窗户1,即Arantius板尾部对应腹侧肝实质,通过该窗户与Arantius板的游离可以找到GateⅠ。窗户2,即肝圆韧带与脐板连接处腹侧的肝实质区,通过该窗户可以找到GateⅡ。窗户3,即第一肝门板处对应的肝方叶的实质区域,打开窗户3,下降肝门板,在其左右可以找到GateⅢ和GateⅣ。窗户4,即位于胆囊板右侧部分,即右前与右后肝蒂夹角处围绕的肝实质,打开窗户4,能够找到GateⅤ,进入右肝蒂分叉区域[13]。门板与窗户的被膜连续,两者之间的连接处即“红黄交界线”[10]。以窗户为标记,沿“红黄交界线”打开和下降门板可以快速地进入门窗间隙。见图2。
1.4 “门”的拓展
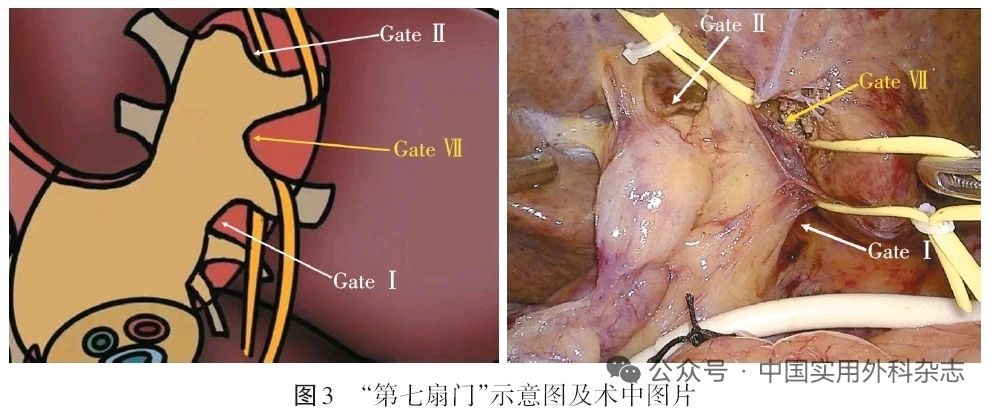
1.4.1 第七扇门 根据笔者对“门”的定义,在GateⅡ与GateⅠ之间也存在一处潜在的肝外裂隙,该裂隙位于S2、S3段肝蒂夹角之间,笔者将其命名为“第七扇门”(GateⅦ)。通过打开第七扇门,可以在鞘外解剖出S2、S3段的肝蒂,从而实现相应肝段的Glisson蒂横断式肝切除。见图3。
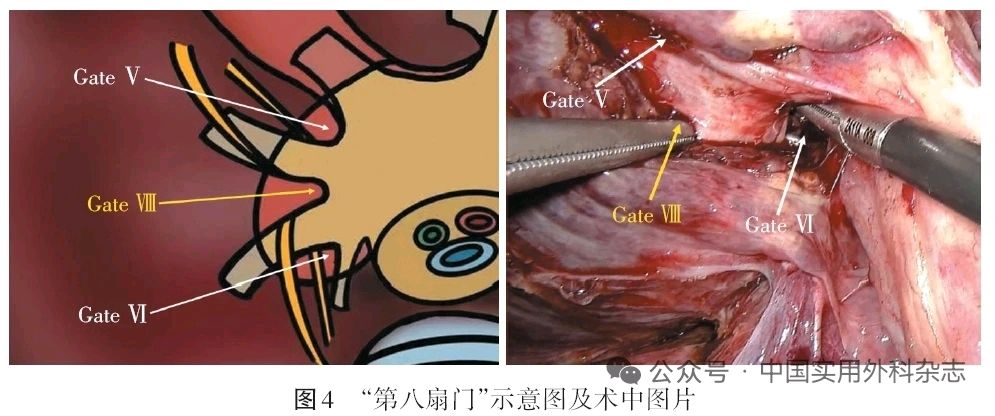
1.4.2 第八扇门 从解剖学角度来看,肝蒂系统左右对称,对应“第七扇门”,在GateⅤ与GateⅥ之间也存在一处“门”,即S6、S7段肝蒂夹角处,笔者将其命名为“第八扇门”(Gate Ⅷ);该“门”偏向头侧,位置更深,需要紧贴S6段肝蒂(G6)、S7段肝蒂(G7)根部的夹角进行游离才能打开。分别经GateⅤ、GateⅥ贯通至GateⅧ,可以完成S6、S7段的Glisson蒂解剖。见图4。
2 “门”的贯通
通过打开不同位置的两个“门”并进行贯通,可以实现不同术式的Glisson蒂横断式肝切除术,如通过贯通Gate Ⅰ~Ⅲ、GateⅣ~Ⅵ可以分别进行左肝蒂、右肝蒂的阻断,完成左右半肝切除术;贯通GateⅣ~Ⅴ、GateⅤ~Ⅵ可以分别进行右前肝蒂、右后肝蒂的阻断,完成右前、右后肝叶切除术;贯通GateⅠ~Ⅱ、GateⅡ~Ⅲ可以分别将左外叶和左内叶肝蒂进行一并阻断,完成左外叶和左内叶Glisson蒂横断式切除;利用Gate Ⅶ和GateⅦ与相邻的“门”贯通,可以完成S2、S3和S6、S7段的肝段切除。见图5及手术视频。
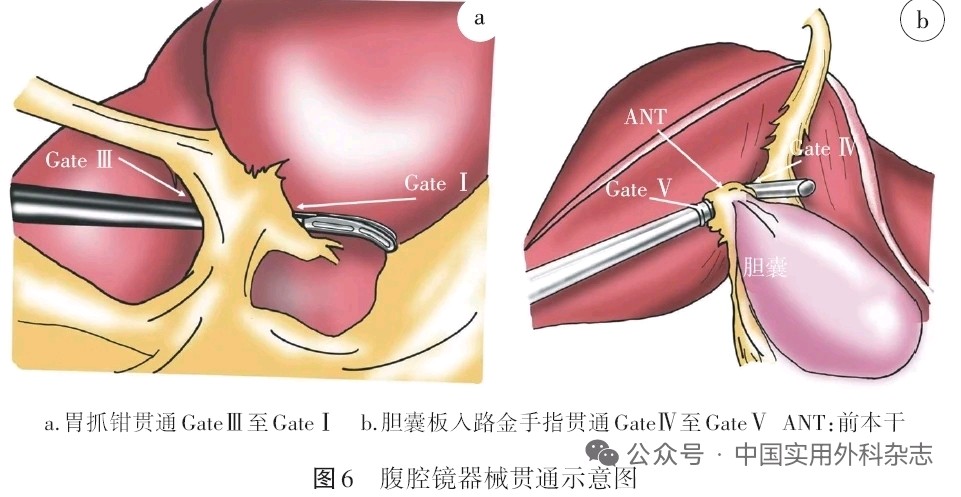
实际操作技巧是通过准确定位窗户与门板之间的“红黄交界线”,以此为着手点使用分离钳或胃抓钳打开并进行横向和纵向的拓展,左手配合使用吸引器等工具将门板与肝实质逐步钝性分离开。重点是通过术者的牵拉使肝实质与门板之间保持一定的张力,这样才可以进入准确的门窗间隙,避免误入肝实质或肝蒂。为了减少打开“门”过程的出血,可以提前进行第一肝门的阻断,创面渗血可以使用双极电凝进行止血;另外,在门窗间隙内应注意门短静脉的存在,必要时进行结扎或缝扎。完成“门”的解剖后,解除肝门阻断后可能会有少量渗血,此时无须特殊处理,可在肝实质与Glisson蒂之间填塞止血材料即可自行止血;如果出现大量出血的情况,需要仔细检查是否损伤门短静脉、肝实质或Glisson蒂,分别进行妥善的处理。 根据不同“门”之间的距离、Glisson蒂的粗细和操作的角度,可以采用分离钳、直角钳、胃抓钳或金手指等腔镜器械进行贯通,在贯通的过程中应动作轻柔,器械紧贴门板这一侧,逐步加压和深入,避免暴力操作。值得推荐的器械是金手指,其头端圆钝,前端采用可伸缩弯曲的设计,可以灵活地将各个门贯通起来,尤其是右侧肝蒂的GateⅣ~Ⅵ和左侧肝蒂的GateⅡ~Ⅲ, GateⅠ~Ⅱ的贯通。见图6。
3 “六扇门”解剖的应用评价
Glisson蒂内管道走形相对复杂,肝动脉、门静脉变异并不少见,因此传统的鞘内Glisson蒂解剖法通常操作过程比较繁杂,操作耗时较长,甚至可能因为鞘内管道的辨认偏差导致误损伤,增加出血及胆漏风险;另外,鞘内法通常只能解剖到一级分支和右侧Glisson蒂二级分支,对于左侧肝蒂的二级分支和右侧肝蒂的三级分支往往无法实现。目前腹腔镜下Glisson蒂鞘内解剖法被逐渐替代,成为鞘外法的补充。Glisson蒂和“门”的解剖相对固定,变异较少,腹腔镜下鞘外解剖法可以实现快速、精准的目标Glisson蒂的解剖和一并处理,避免打开Glisson鞘导致的出血及胆漏的风险,也减少了鞘内管道变异引起的误损伤[14-15]。基于“六扇门”解剖理论结合笔者提出的“八扇门”,实现了对Glisson蒂一至三级分支的解剖,可以完成大部分解剖性肝切除术式。通过鞘外解剖可以对Glisson蒂提前解剖游离和阻断,可以进行ICG荧光负染,实现门静脉流域的肝切除[16-17]。相较于正染技术,负染技术不需要较长的学习曲线来掌握腹腔镜下超声引导穿刺门静脉技术,更加有利于初学者开展。另外,由于经“门”进行鞘外解剖的安全性和便捷性,对一些肝硬化严重的肝脏可以采用“门入路”进行区域血流阻断,避免第一肝门血流阻断对肝功能造成的影响。
腹腔镜Glisson蒂横断式肝切除术存在一定的局限性。不适合Glisson蒂一并横断的场景包括肝胆管结石、门静脉癌栓、肝门部胆管癌等疾病;另外紧贴肝门区的巨大肿瘤,采用“门入路”在贯通的过程中可能损伤肿瘤包膜导致破裂,不推荐使用Glisson蒂横断法。右前区Glisson蒂的分支数目较多且分散,S5、S8段之间的肝蒂无明显的肝外裂隙,因此难以经“门入路”一并处理S5、S8段的Glisson蒂。另外,尾状叶的Glisson蒂供应支位于“六扇门”的区域以外,无法通过“门解剖”实现解剖性尾状叶切除。
Sugioka所提出的“六扇门”未涉及左外叶、右后叶区域的段间解剖的方法。笔者团队在临床实践中,通过对第一肝门解剖的再研究,发现在S2段肝蒂(G2)和S3段肝蒂(G3)的Glisson蒂根部之间、G6和G7的Glisson蒂根部之间存在潜在的门窗间隙。笔者团队将前者命名为“第七扇门”,通过贯通GateⅦ至GateⅠ、GateⅡ,可以分别完成S2、S3段流域性肝段切除术。对于部分合并严重肝硬化的左外叶小肝癌,荷瘤肝段切除可以保留更多肝体积。笔者团队将后者命名为“第八扇门”,应用于S6、S7段的切除,由于G6分支复杂,多为多支型,相比经路氏沟解剖,经Gate Ⅴ贯通至GateⅧ的入路可以一并结扎所有G6分支,避免遗漏。由于G7多发向头侧,位置较深,既往多采用劈开并牺牲尾状突的方法寻找G7[18],利用GateⅧ的入路可以快速找到G7,避免破坏尾状突。
“门”的解剖位置相对固定,通过门板及窗户等解剖结构可以快速定位“门”,但在临床实践中也存在Glisson蒂变异的情况,需要结合影像尤其是三维可视化结果个体化地规划“门”的入路,不应生搬硬套“六扇门”或“八扇门”理论。基于“门”解剖的腹腔镜Glisson蒂横断式肝切除术,适用于大部分解剖性肝切除术式,鞘外解剖法简便易行、实用性强,也是荧光反染的必要技术之一。该方法有利于LLR的精准化、规范化和流程化的开展,具有广泛的临床前景,值得进一步推广。
利益冲突 所有作者均声明不存在利益冲突作者贡献声明 陈雪芳:论文初稿撰写、图片绘制;张彤:论文修改;郑志鹏:视频剪辑、论文内容设计与终稿审定
参考文献(在框内滑动手指即可浏览)
[1] 王安志,张帆,杜京洋,等. 腹腔镜门静脉流域解剖性肝切除技术发展及要点[J]. 中国普通外科杂志,2025,34(1):62-69. DOI:10.7659/j.issn.1005-6947.240568.[2] 中国研究型医院学会肝胆胰外科专业委员会, 《中华消化外科杂志》编辑委员会. 腹腔镜解剖性肝切除手术操作流程及技术标准中国专家共识(2023版)[J].中华消化外科杂志, 2023, 22(7): 810-823. DOI:10.3760/cma.j.cn115610-20230714-00410.[3] Wang X, Cao J, Li J. Anatomic liver resection based on portal territory with margin priority for hepatocellular carcinoma[J]. JAMA Surg, 2024, 159(6):710-711. DOI: 10.1001/jamasurg.2023.5904.[4] Fujiyama Y, Wakabayashi T, Mishima K, et al. Latest findings on minimally invasive anatomical liver resection[J]. Cancers (Basel), 2023,15(8):2218. DOI: 10.3390/cancers15082218.[5] Takasaki K. Glissonean pedicle transection method for hepatic resection: a new concept of liver segmentation[J]. J Hepatobiliary Pancreat Surg,1998,5(3):286-291. DOI: 10.1007/s005340050047.[6] Guo Y, Huang W, Luo B, et al. Minimally invasive anatomic resection of liver segment Ⅷ based on portal territory to treat hepatocellular carcinoma[J]. J Vis Exp, 2025, 6:220. DOI: 10.3791/67865. [7] Sugioka A, Kato Y, Tanahashi Y. Systematic extrahepatic Glissonean pedicle isolation for anatomical liver resection based on Laennec's capsule: proposal of a novel comprehensive surgical anatomy of the liver[J]. J Hepatobiliary Pancreat Sci, 2017,24(1):17-23. DOI: 10.1002/jhbp.410.[8] Kato Y, Sugioka A, Kojima M, et al. Minimally invasive anatomic liver resection for hepatocellular carcinoma using the extrahepatic glissonian approach: surgical techniques and comparison of outcomes with the open approach and between the laparoscopic and robotic approaches[J]. Cancers (Basel), 2023,15(8):2219. DOI:10.3390/cancers15082219. [9] Kato Y, Sugioka A, Kojima M, et al. Impact of minimally invasive surgery on anatomic liver segmentectomy using the extrahepatic glissonean approach[J]. J Pers Med, 2024,14(1):120. DOI: 10.3390/jpm14010120.[10] 杨陈凤麟,李尧,王鑫,等. “门理论”在微创解剖性肝切除术中的应用与展望[J].中国实用外科杂志, 2024, 44(3):341-345. DOI:10.19538/j.cjps.issn1005-2208.2024.03.21.[11] 陈雪芳, 熊子慧, 叶青, 等. 经Glisson鞘左、右半肝血流阻断法在腹腔镜解剖性肝中叶切除术中的应用[J]. 肝胆胰外科杂志,2023,35(1):25-29. DOI:10.11952/j.issn.1007-1954.2023.01.005.[12] 王恺, 孙世波, 李芷西, 等. 胆囊板入路右肝蒂鞘外解剖法在微创解剖性肝切除术中的应用价值[J].中华消化外科杂志,2023,22(4):489-496. DOI:10.3760/cma.j.cn115610-20230321-00119.[13] Chen J, Zhang Z, Zhou R, et al. The APR triangle: a practical zone in the Glissonean approach to laparoscopic anatomical right hepatectomy[J]. ILIVER, 2022,1(3):176-180. DOI: 10.1016/j.iliver.2022.08.004. [14] Li B, Yin D, Zhang Q, et al. Laennec approach for anatomical liver resection assisted by laparoscopy or robotics: a multicenter cohort study[J]. Int J Surg, 2025,111(2):1929-1938. DOI: 10.1097/JS9.0000000000002212.[15] 郑树国, 旷钥文, 郑博文. 保证腹腔镜肝脏手术安全性的关键技术环节[J]. 中国实用外科杂志, 2025, 45 (1): 75-79. DOI:10.19538/j.cjps.issn1005-2208.2025.01.12.[16] Chen H, Shen K, Shen X, et al. Cystic plate approach combined with ICG fluorescence in laparoscopic anatomical hepatectomy[J]. Int J Surg, 2024,110(9):5685-5695. DOI: 10.1097/JS9.0000000000001706.[17] 程东辉,杨冲,蒋佶朋,等. 超声引导下经皮经肝注射吲哚菁绿与声诺维混合剂在腹腔镜肝锥形单元切除中的应用研究[J]. 中国实用外科杂志,2024,44(2):211-215. DOI:10.19538/j.cjps.issn1005-2208.2024.02.19.[18] Homma Y, Honda G, Kurata M, et al. Pure laparoscopic right posterior sectionectomy using the caudate lobe-first approach[J]. Surg Endosc, 2019,33(11):3851-3857. DOI: 10.1007/s00464-019-06877-w.
(2025-06-20收稿)
版权声明
本文为《中国实用外科杂志》原创文章。其他媒体、网站、公众号等如需转载本文,请联系本刊编辑部获得授权,并在文题下醒目位置注明“原文刊发于《中国实用外科杂志》,卷(期):起止页码”。谢谢合作!