
中国实用外科杂志 2025年07月28日 辽宁
通信作者:吴向嵩教授(左)龚伟教授(右)
陈诗雨医师
【引用本文】陈诗雨,吴向嵩,龚 伟. 胆道恶性肿瘤围手术期化疗及联合治疗策略的进展[J]. 中国实用外科杂志,2025,45(7):835-840.
DOI:10.19538/j.cjps.issn1005-2208.2025.07.20
胆道恶性肿瘤围手术期化疗及联合治疗策略的进展
陈诗雨,吴向嵩,龚 伟
中国实用外科杂志,2025,45(7):835-840DOI:10.19538/j.cjps.issn1005-2208.2025.07.20
摘要 胆道恶性肿瘤(BTC)是一类高度异质且生物学行为侵袭性强的消化系统肿瘤。围手术期系统治疗可实现术前肿瘤降期、提高手术切除率,术后清除潜在微转移灶、延缓复发,已成为BTC综合管理的重要方向。以吉西他滨为基础的化疗仍是核心治疗策略,近年来,多项研究探索了新辅助治疗、转化治疗以及辅助治疗中化疗联合免疫检查点抑制剂和酪氨酸激酶抑制剂等多模式方案的疗效,部分联合方案已显示出提高R0切除率及改善生存的潜力。未来研究应完善术前与术后免疫联合方案的标准流程与疗效评价体系,基于分子分型和免疫表型实施个体化策略,并统一“边界可切除”与“不可切除”定义、开发预测生物标记物,以精准筛选获益人群、优化剂量序贯。
基金项目:上海市卫健委卫生健康学科带头人项目(No.2022XD010);上海市科学技术委员会“科技创新行动计划”医学创新研究专项(No.22Y11908000) 作者单位:上海交通大学医学院附属新华医院普外科 上海交通大学医学院胆道疾病实验室 上海市胆道疾病研究重点实验室 上海市胆道疾病研究中心,上海 200092通信作者:吴向嵩,E-mail:wxswkys@163.com;龚伟,E-mail:gongwei@xinhuamed.com.cn注:吴向嵩为中国普通外科青年学者攀登计划成员 胆道恶性肿瘤(biliary tract cancer,BTC)是一类起源于胆道上皮的高度异质性肿瘤,根据解剖部位分可为肝内胆管癌(intrahepatic cholangiocarcinoma,iCCA)、肝外胆管癌(extrahepatic cholangiocarcinoma,eCCA)和胆囊癌(gallbladder cancer,GBC),其中肝外胆管癌进一步分为肝门部胆管癌(hilar cholangiocarcinoma,hCCA)和远端胆管癌(distal cholangiocarcinoma,dCCA)[1]。尽管病理切缘阴性的根治性切除(R0)是目前唯一可能治愈BTC的方法,但多数病人在确诊时已处于中晚期,R0切除率仅为20%~30%,且术后复发转移率高,导致5年总生存率(overall survival,OS)仅为5%~15%[2-3]。目前,围手术期治疗策略已被证实可改善多种实体瘤远期预后,其在BTC领域的研究亦逐步展开[4]。其挑战在于:一方面,新辅助治疗和转化治疗尚缺乏标准方案与高质量循证证据,适应人群界定不明确;另一方面,辅助治疗对不同分型病人的真实获益仍存在争议,尤其是在免疫与靶向治疗快速发展的背景下,传统化疗的定位亟待重塑。本文对BTC围手术期化疗及其联合治疗策略的研究进展做一综述。
1 新辅助治疗中国临床肿瘤学会(CSCO)指南借鉴胰腺癌围手术期管理经验,提出“边界可切除”BTC的概念,适用于具有血管侵犯、肿瘤负荷大、多灶性病变、区域淋巴结转移或其他高复发风险因素,但未发生远处转移的病人[5]。此类病人推荐在多学科综合治疗协作组(multidisciplinary team,MDT)指导下进行个体化评估与治疗策略制定,以提高手术安全性与R0切除率。 目前,吉西他滨+顺铂(GC)仍为新辅助治疗的基线方案,其疗效受病人筛选、治疗周期和联合策略等多因素影响。ABC‑02研究中,GC方案在晚期BTC病人的客观缓解率(objective response rate,ORR)为26.1%,疾病控制率(disease control rate,DCR)为81.4%[6]。GAIN研究纳入边界可切除、美国东部肿瘤协作组(Eastern Cooperative oncology Group,ECOG)体能状态评分良好的病人,经3个周期GC方案治疗后R0切除率达62.5%,DCR为85%,中位总生存期延长至27.8个月[7]。NEO-GAP研究在GC方案基础上联合白蛋白紫杉醇(GAP方案)并延长疗程,R0切除率和DCR分别达到61.9%、79.2%[8]。 除系统治疗外,新辅助同步放化疗结合了放疗的局部控制和化疗的全身效果,理论上可进一步提高手术切除率、延长生存期[9]。目前,吉西他滨或氟尿嘧啶(5-FU)为常用同步放化疗药物。Kobayashi等[10]回顾性研究结果显示,吉西他滨联合放疗的R0切除率为96%,3年OS为75%;Jung等[11]报道,5-FU或吉西他滨联合外照射放射治疗亦有一定降期效果。2025年,美国临床肿瘤学会(ASCO)年会中发布的POLCAGB Ⅲ期试验结果显示,GC+替吉奥(GCS方案)联合放疗较单纯化疗显著提高R0切除率(51.6% vs. 29.7%)和总生存期(21.8个月 vs. 10.1个月),且显示出良好的安全性[12]。 近年来,BTC新辅助治疗逐渐向精准化方向发展。以免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)为核心的联合方案在新辅助治疗取得初步突破。DEBATE研究结果显示,GC联合程序性死亡配体1(programmed death-ligand 1,PD-L1)抑制剂度伐利尤单抗较单用GC可显著提高ORR(36% vs. 7%)、DCR(89% vs. 50%)和R0切除率(61% vs. 36%)[13]。多中心Ⅲ期随机对照试验TOPAZ-1和KEYNOTE-966研究在晚期BTC病人中亦证实联合ICIs的生存获益,为新辅助治疗提供重要依据[14-15]。在靶向治疗方面,多靶点酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKIs)联合ICIs及化疗的方案正在被探索性应用于围手术期治疗,初步研究结果显示出良好的协同治疗作用。 目前,BTC新辅助治疗的临床研究持续推进,重点聚焦多药联合及免疫联合方案的降期潜力,相关研究概况如表1所示。这些研究普遍纳入无远处转移但伴高风险因素的ECOG 0~1分病人,并强调治疗过程中动态评估以优化术式选择。
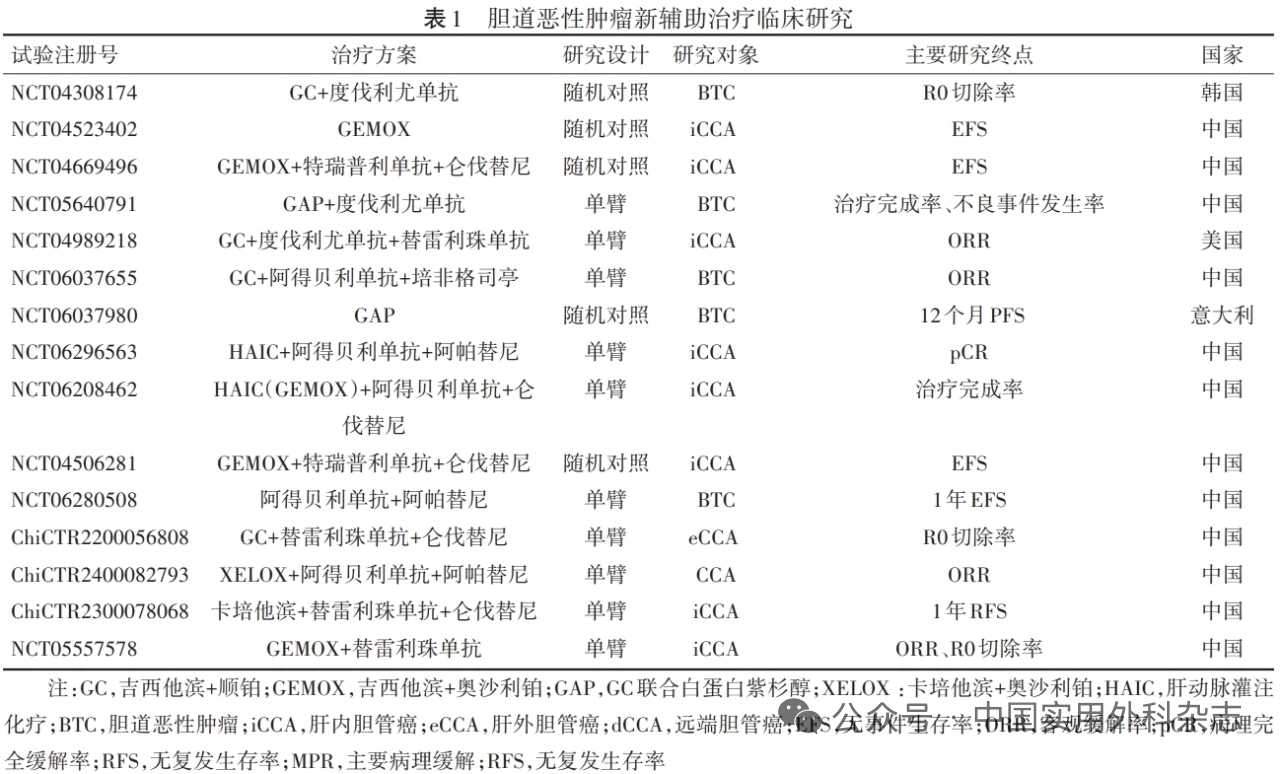
BTC新辅助治疗需要综合肿瘤亚型、功能评分及伴随疾病进行精准分层。ECOG 0~1分且肝肾功能良好、血清CA19-9轻或中度升高者,可首选GC方案;年轻、体能状态良好、无严重骨髓抑制及神经系统疾病者可尝试多药联合方案[如GAP、GCS或FOLFIRINOX(5-FU+亚叶酸钙+伊立替康+奥沙利铂)],但建议初期减量并加强支持治疗[16-18];对于存在肾功能障碍的病人,则应优先选择奥沙利铂替代顺铂的方案[19];高龄或伴有多种基础疾病者可选口服方案或低强度双药化疗,免疫标记物阳性者亦可考虑ICIs单药;治疗期间需采用影像学检查(CT、MRI、PET-CT)进行动态评估;若疗效不足或出现≥Ⅲ级毒性反应,应及时减量或停治,以免延误手术时机。
2 转化治疗转化治疗的概念常与新辅助治疗混淆。二者虽均为术前系统性治疗手段,但适用人群存在显著差异。新辅助治疗通常应用于边界可切除病人;而转化治疗则主要针对初诊时因技术或肿瘤因素不可切除的病人,通过系统性治疗实现肿瘤降期,进而获得根治性手术机会[20]。因此,转化治疗方案须兼顾较高的ORR和可接受的安全性,以最大程度提升肿瘤可切除性。须指出,部分病人因胆红素明显升高或肝功能储备不足,短期内既不能耐受手术也不适合化疗,本文讨论范围不包含此类人群。 BTC转化治疗仍处于探索阶段,主要治疗方案参照晚期BTC的一线治疗策略。Kato等[21-22]报道,吉西他滨单药或GC方案可使18%~26%的局部晚期病人实现R0切除,转化手术者生存期显著优于单纯化疗者。2020年,一项多中心回顾性研究纳入24例接受转化手术的BTC病人,R0切除率为83%,5年OS为43.2%,中位总生存期为57.4个月,明显优于未手术组的14.4个月[23]。然而,上述研究多为回顾性分析,样本量有限,结果可能存在选择偏倚及治疗异质性。多药联合治疗在提升转化率方面表现出一定潜力。Shroff等[16]开展的Ⅱ期研究中,12例病人使用GAP方案后进行转化手术,ORR为37%,但存在较高的≥Ⅲ级毒性反应发生率(58%)。与之相比,吉西他滨+白蛋白紫杉醇(AG方案)在单中心研究中显示出较好的耐受性和转化潜力[24-25]。2025年,一项纳入96项研究的Meta分析结果显示,在不可切除BTC病人中,接受转化手术者的中位总生存期为36.8个月,显著优于未手术组的22.4个月(HR=0.39,P<0.001),其长期生存与初始可切除病人相当[26]。 转化手术需要较高的ORR才能创造手术机会,而单药化疗的反应率相对较低,多项研究表明,ICIs联合TKIs和化疗可显著提升晚期BTC病人的转化成功率。一项Ⅱ期临床研究结果显示,卡瑞利珠单抗联合吉西他滨+奥沙利铂(GEMOX方案)治疗晚期BTC病人的ORR达53.8%,中位总生存期为11.8个月[27]。Shi等[28]在GEMOX基础上联合特瑞普利单抗和仑伐替尼治疗晚期iCCA,ORR高达80%,DCR达93.3%,中位总生存期和无进展生存期分别为22.5、10.2个月,3例(10%)病人实现转化手术。Li等[29]采用GEMOX联合仑伐替尼和替雷利珠单抗(GOLP方案)治疗局部晚期BTC,ORR为56%,52%的病人实现R0切除。Fan等[30]在一项前瞻性Ⅱ期多中心研究中同样采用GOLP方案,ORR达43.9%,DCR为87.8%,48.8%病人实现R0切除。尽管现有研究证据显示,TKIs联合ICIs策略可提升转化成功率,但多为单臂、小样本、单中心试验,且随访时间有限,缺乏长期疗效与安全性的充分验证。 《胆道恶性肿瘤转化治疗专家共识(2025)》提出,化疗方案应根据病人肝功能、胆道梗阻、感染状态及分子特征个体化制定,优选高ORR、起效快且安全性高的免疫联合化疗方案。对高龄或功能受损者可采用毒性较低或减量方案。治疗过程中应每2个周期评估疗效并动态调整,在药物累积毒性可控的前提下,建议延续原治疗方案完成6~8个周期的围手术期辅助治疗。 “不可切除BTC”的定义尚无统一标准,影响了跨研究的结果可比性。根据美国癌症联合委员会(American Joint Committee on Cancer,AJCC)TNM分期系统(2017年第8版),hCCA侵犯门静脉主干或其双侧分支、侵犯肝总动脉或侵犯双侧的二级胆管,一侧二级胆管的肿瘤侵及对侧的门静脉或肝动脉,则无法行R0切除。部分研究结果认为在此种情况下,若结合积极的血管切除和重建,仍有机会实现R0切除[31]。Kato等[21]提出局部晚期不可切除BTC包括血管受累无法重建、胆管广泛侵犯或残肝体积不足等情况。为进一步明确适应证,笔者中心结合胰腺癌的边界可切除和局部进展期标准,提出“新华标准”,以指导GBC病人转化治疗和新辅助治疗的分型决策[20,32]。 转化治疗为初始不可切除BTC病人提供了根治性治疗机会。三药或四药联合方案在提升ORR与R0切除率方面展现出良好前景,部分方案R0切除率已>50%。但现有证据多来自非随机、单中心研究,缺乏统一标准,仍需以高质量、多中心前瞻性研究明确疗效及适应人群,以推动临床转化治疗的标准化与精准化实践[23]。
3 辅助治疗即使已进行R0切除手术,BTC仍具有较高的复发风险。术后辅助治疗的目标是清除潜在的微转移灶,降低复发率,延长生存期。2002年,日本一项针对可切除胆胰系统肿瘤的Ⅲ期多中心研究结果发现,术后接受丝裂霉素C+5-FU (MF方案)辅助化疗的GBC病人,其5年OS显著提高(26.0% vs. 14.4%),但治疗获益主要集中于非R0切除病人亚组[33]。此后,多项Ⅲ期临床研究进一步探索了根治术后辅助化疗的价值。日本一项多中心Ⅲ期试验BCAT研究以eCCA病人为研究对象,比较术后吉西他滨与观察组的临床疗效,总生存期(62.3个月 vs. 63.8个月)和无复发生存期(36.0个月 vs. 39.9个月)方面差异均无统计学意义[34]。法国Ⅲ期随机对照试验PRODIGE 12/ACCORD-18研究评估术后GEMOX方案的辅助疗效,尽管GEMOX组病人的无进展生存期更长(30.4个月 vs. 18.5个月),但总生存期并未明显改善[35]。英国多中心Ⅲ期随机对照试验BILCAP研究系统评价了卡培他滨辅助治疗的疗效[36]。共纳入447例iCCA、eCCA和GBC病人,采用意向性治疗(intention-to-treat,ITT)和符合方案(per-protocol,PP)双重分析方法。ITT分析中,卡培他滨组中位总生存期为51.1个月,虽优于对照组(36.4个月),但差异无统计学意义(HR=0.81,P=0.097);而在PP人群中,总生存期差异具有统计学意义(HR=0.75,P=0.028),无进展生存期亦显著延长。亚组分析结果提示,高风险病人可能获益更大。ASCOT研究在亚洲人群中进一步验证了替吉奥的疗效,3年OS达77.1%,显著优于观察组的67.6%[37]。基于上述证据,卡培他滨和替吉奥已被国内外多部指南推荐为BTC术后辅助化疗的首选方案[2,38-39]。 在辅助放化疗方面,多中心Ⅱ期临床试验SWOG 0809研究纳入79例R0/R1切除后病人,评估GEMOX方案化疗后序贯放疗联合卡培他滨同步治疗的效果,结果显示,中位总生存期达35个月,2年OS为65%,但因缺乏Ⅲ期试验结果验证,结论仍需辩证看待[40]。根据我国《胆道恶性肿瘤全程规范化管理中国专家共识》,对于分期为T2期及以上的根治性切除术后病人,以及R1切除或淋巴结转移阳性病人,可考虑用5-FU或卡培他滨行术后辅助同步放化疗。 ICIs联合方案在BTC术后辅助治疗中同样逐渐进行探索应用。ACTIVE研究结果显示,替雷利珠单抗联合卡培他滨可延长高复发风险病人的无病生存期[41];全球多中心Ⅲ期试验ARTEMIDE-Biliary 01研究正在评估PD-1/T细胞免疫球蛋白和免疫受体酪氨酸抑制性基序结构域[T-cell immunoglobulin and immuno-receptor tyrosine-based inhibitory motif domain,TIGIT]双抗Rilvegostomig联合化疗的疗效[42]。正在进行中的多中心随机对照试验ChiCTR2400088474评估替雷利珠单抗联合卡培他滨用于根治术后BTC病人辅助治疗的价值。该研究基于PD-L1、微卫星不稳定性(microsatellite instability,MSI)、肿瘤突变负荷(tumor mutational burden,TMB)状态分层,并引入术后循环肿瘤DNA(circulating tumor DNA,ctDNA)动态监测,以探索不同生物标记物亚组对免疫联合治疗的疗效和复发风险的预测作用。 总体上,辅助治疗可能对高风险病人更具益处。多数临床指南建议术后接受6~8个周期以5-FU类药物为基础的辅助治疗。在临床实践中,辅助治疗应基于肿瘤亚型、分期等多因素综合评估。未来研究应着重于高复发风险人群的精准识别,并进一步探索辅助治疗与生物标记物表达之间的关联,从而优化术后治疗策略,提升生存获益的可预测性和个体化管理水平。 综上所述,BTC因其高度异质性和侵袭性,整体病人预后不佳,围手术期的系统性综合干预已成为提升根治切除率与远期生存率的关键策略。当前治疗模式正由经验化向精准化、分层化及多模式融合方向演进,未来应聚焦以下关键方向:(1)明确免疫联合化疗在术前术后应用中的标准化路径与疗效评估体系。(2)依据分子分型和免疫表型制定个体化治疗方案,优化药物选择与剂量调整。(3)统一“边界可切除”和“可转化切除”的判定标准,规范手术时机与治疗流程。(4)开发疗效预测和复发监测的分子标记物体系,实现病人筛选与动态管理的科学化。展望未来,高质量的前瞻性研究和真实世界数据将为BTC围手术期治疗提供坚实的循证基础,推动治疗范式不断更新与临床落地转化。
利益冲突 所有作者均声明不存在利益冲突作者贡献声明 龚伟、吴向嵩、陈诗雨负责选题与设计;陈诗雨负责搜集资料、撰写和修改文章;吴向嵩、龚伟指导论文修改并负责文章的总体质量控制
参考文献(在框内滑动手指即可浏览)
[1] Amin MB, Greene FL, Edge SB, et al. The eighth edition AJCC cancer staging manual: Continuing to build a bridge from a population-based to a more "personalized" approach to cancer staging [J]. CA Cancer J Clin, 2017, 67(2): 93-99. DOI: 10.3322/caac.21388.[2] Shroff RT, Kennedy EB, Bachini M, et al. Adjuvant therapy for resected biliary tract cancer: ASCO clinical practice guideline [J]. J Clin Oncol, 2019, 37(12): 1015-1027. DOI: 10.1200/jco.18.02178.[3] 中国抗癌协会胆道肿瘤专业委员会. 中国抗癌协会胆道恶性肿瘤靶向及免疫治疗指南(2024)(简要版) [J]. 中国实用外科杂志, 2024, 44(9): 970-979. DOI:10.19538/j.cjps.issn1005-2208.2024.09.02.[4] Yıldız İ, Özer L, Şenocak Taşçı E, et al. Current trends in perioperative treatment of resectable gastric cancer [J]. World J Gastrointest Surg, 2023, 15(3): 323-37. DOI: 10.4240/wjgs.v15.i3.323.[5] 中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)胆道恶性肿瘤诊疗指南[M]. 北京:人民卫生出版社,2023.[6] Valle J, Wasan H, Palmer DH, et al. Cisplatin plus gemcitabine versus gemcitabine for biliary tract cancer [J]. N Engl J Med, 2010, 362(14): 1273-1281. DOI: 10.1056/NEJMoa0908721.[7] Goetze TO, Bechstein WO, Bankstahl US, et al. Neoadjuvant chemotherapy with gemcitabine plus cisplatin followed by radical liver resection versus immediate radical liver resection alone with or without adjuvant chemotherapy in incidentally detected gallbladder carcinoma after simple cholecystectomy or in front of radical resection of BTC (ICC/ECC) - a phase Ⅲ study of the German registry of incidental gallbladder carcinoma platform (GR)- the AIO/ CALGP/ ACO- GAIN-trial [J]. BMC Cancer, 2020, 20(1): 122. DOI: 10.1186/s12885-020-6610-4.[8] Maithel SK, Keilson JM, Cao HST, et al. NEO-GAP:A single-arm, phase ii feasibility trial of neoadjuvant gemcitabine, cisplatin, and nab-paclitaxel for resectable, high-risk intrahepatic cholangiocarcinoma [J]. Ann Surg Oncol, 2023, 30(11): 6558-6566. DOI: 10.1245/s10434-023-13809-5.[9] Sumiyoshi T, Shima Y, Okabayashi T, et al. Chemoradiotherapy for initially unresectable locally advanced cholangiocarcinoma [J]. World J Surg, 2018, 42(9): 2910-2918. DOI: 10.1007/s00268-018-4558-1.[10] Kobayashi S, Tomokuni A, Gotoh K, et al. Evaluation of the safety and pathological effects of neoadjuvant full-dose gemcitabine combination radiation therapy in patients with biliary tract cancer [J]. Cancer Chemother Pharmacol, 2015, 76(6): 1191-1198. DOI: 10.1007/s00280-015-2908-3.[11] Jung JH, Lee HJ, Lee HS, et al. Benefit of neoadjuvant concurrent chemoradiotherapy for locally advanced perihilar cholangiocarcinoma [J]. World J Gastroenterol, 2017, 23(18): 3301-3308. DOI: 10.3748/wjg.v23.i18.3301.[12] Engineer R, Goel M, Ostwal V, et al. A phase Ⅲ randomized clinical trial evaluating perioperative therapy (neoadjuvant chemotherapy versus chemoradiotherapy) in locally adva