
iNature 2025年07月28日 11:09
血性中风是世界主要死因之一,其伴随的血脑屏障 (BBB) 功能障碍会加重神经元损伤。然而,中风后慢性期 BBB 修复的潜在机制仍不清楚。
2025年7月16日,西湖大学贾洁敏和Li Tingbo 共同通讯在eLife在线发表题为“The myeloid cell-driven transdifferentiation of endothelial cells into pericytes promotes the restoration of BBB function and brain self-repair after stroke”的研究论文。该研究分析了 C57BL/6 小鼠中风模型中周细胞池的改变及其对 BBB 完整性和脑恢复的影响。
谱系追踪、RNA 测序和免疫荧光染色揭示了中风后 C57BL/6 小鼠中内皮细胞 (EC) 转分化为周细胞 (E-周细胞)。白喉毒素 A (DTA) 导致 E-周细胞耗竭,加剧了 MCAO 模型中的 BBB 渗漏并加剧了神经功能缺损。髓系细胞驱动的 EC 转分化为周细胞,通过内皮-间质转化 (EndoMT) 加速了中风后 BBB 的修复和脑的自我修复。通过特异性敲除内皮细胞(EC)中的Tgfbr2基因来减少E-周细胞的数量,也会加剧血脑屏障(BBB)渗漏,并加剧神经功能缺损。内皮细胞特异性过表达Tgfbr2基因,促进E-周细胞转分化,可减少血脑屏障渗漏并发挥神经保护作用。揭示E-周细胞协调卒中后恢复的机制,或将为治疗带来新的机遇。

所有脊椎动物都进化出了在事故或冲突后进行组织修复的策略,有效的组织修复对于生存至关重要。肝脏是唯一能够通过再生精确调节自身质量以维持肝体重比在代谢稳态所需的最佳范围内的实体器官。血管修复对肝脏再生和皮肤伤口愈合至关重要,因为血管可以提供营养和氧气以促进慢性期的组织修复和功能恢复。肝脏和皮肤表现出强大的组织自我修复能力,这得益于血管修复。作为最重要的器官之一,目前关于血管修复对大脑自我修复的贡献的认识和研究还不够充分。
中风会因持续缺血和缺氧导致大规模细胞死亡,这仍然是成年人残疾和死亡的主要原因。中风后大脑中明确的自发修复过程在很大程度上仍不清楚,解码和利用这些过程可能会加速大脑的恢复,而这通常需要数年时间。直到最近,这方面的努力主要涉及保护性营养因子和细胞移植,旨在挽救或替换特定的神经元群,但临床结果大多令人失望。及时恢复急性期的血管再灌注是减少神经元死亡和限制急性损伤的治疗方法。目前尚无经过验证的医学疗法可以在慢性期恢复脑血流 (CBF)。不幸的是,关于在慢性修复期通过修复中风后的血管进行大脑自我修复的知识仍然很少。
血管层次包括动脉、小动脉、毛细血管、小静脉和静脉。营养和气体交换主要发生在毛细血管床中,毛细血管床占血管长度的 90%。毛细血管主要由内皮细胞 (EC) 和周细胞组成,它们维护毛细血管床的功能。中风后,EC 和周细胞对不同的反应和命运作出反应。中风后,周细胞迅速表现出凋亡和死亡;然而,EC 可以耐受缺血和缺氧。当周细胞丢失时,血脑屏障 (BBB) 和 CBF 的功能就会被破坏。BBB 作为一种选择性通透的界面,可精确调节循环和中枢神经系统 (CNS) 之间的物质交换,从而维持正常神经元信号传导所必需的特殊微环境。有效的 CBF 对中风后脑细胞存活至关重要。预防BBB渗漏和周细胞丢失导致的CBF减少对中风后的血管和神经功能具有重要意义。
内皮具有很强的可塑性。胚胎中的某些内皮细胞会经历造血转化,产生多谱系造血干细胞和祖细胞,这些细胞对于血液系统的发育至关重要。内皮细胞可以经历 EndoMT,获得间充质特性。这一过程在各种病理条件下都很重要,例如纤维化和癌症。心内膜内皮细胞是通过 EndoMT 分化为小鼠胚胎心脏中周细胞和平滑肌细胞 (SMC) 的祖细胞。表达蛋白 C 受体 (Procr) 的内皮细胞会在乳腺中引起内皮细胞和周细胞的从头形成。在慢性修复期,是否存在一种自我修复机制可以从内皮细胞中补充周细胞池,从而保护中风后的血管,但这种机制尚不清楚?
在卒中后的急性期和亚急性期,髓系细胞是进入脑实质的主要免疫细胞。大多数髓系细胞不能长期占据缺血的脑组织,并通过释放各种因子(包括促炎、抗炎和营养因子)而逐渐消失。使用抗 CCR2 抗体和 CCR2 基因敲除小鼠阻断髓系细胞募集,可通过减少抗炎巨噬细胞和血管生成来损害卒中后的长期自发行为恢复。在远端大脑中动脉闭塞 (dMCAO) 的小鼠中,TGFβ1 主要与 CD68 激活的小胶质细胞和巨噬细胞共定位。重要的是,TGFβ1 参与了人类卒中患者的血管生成发病机制。同时,TGFβ 是 EndoMT 的主要驱动因素,参与小鼠胚胎心脏和乳腺中内皮细胞向周细胞的转变。然而,髓系细胞是否可以通过 EndoMT 驱动内皮细胞向周细胞转化,从而补充周细胞池并修复慢性期中风后的血管功能仍不清楚。
内皮细胞(EC)向外皮周细胞(E-周细胞)的分化补充了周细胞库,对脑卒中后血脑屏障(BBB)的修复和脑的自我修复至关重要。在脑中动脉闭塞(MCAO)模型中,缺血性损伤引发了髓系细胞通过TGFβ1-TGFβR2-EndoMT通路介导的内皮向周细胞转化。E-周细胞数量的动态变化直接影响血脑屏障的完整性和长期功能恢复。这一先前被忽视的机制不仅能够恢复周细胞库,还能增强内源性脑修复,为脑卒中康复提供了一种新的治疗途径。
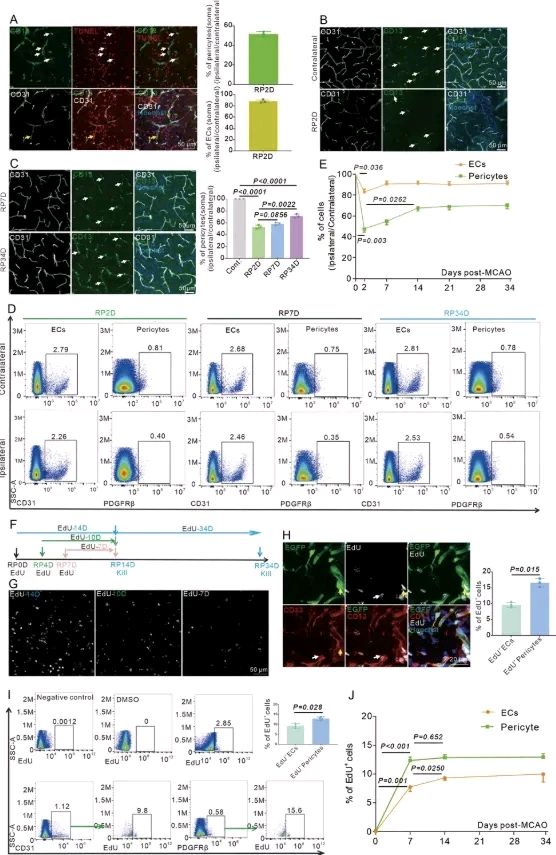
图1中风后,周细胞在急性期迅速死亡,并在亚急性期和慢性期得到补充(图源自eLife)
参考消息:https://elifesciences.org/articles/105593