
iNature 2025年07月17日 10:40
厌氧菌介导的肿瘤治疗面临诸多挑战,包括潜在的毒副作用、复杂的制备工艺以及缺氧靶向性受损。
2025年7月15日,华中科技大学王芹及杨祥良共同通讯在Nature Communications 在线发表题为“Living therapeutics of nonpathogenic bacteria as biosynthesis factory and active carriers for enhancing tumor-targeted therapy”的研究论文,该研究基于天然厌氧硫酸盐还原菌(SRB)优异的生物相容性和将硫酸盐分解为硫化物的独特代谢能力,构建了原位生物合成的硫化亚铁纳米颗粒-SRB(FeS@SRB)生物杂化材料,以增强肿瘤靶向治疗。
有趣的是,SRB既充当生物合成工厂,又充当活性肿瘤靶向递送载体。系统的研究表明,FeS@SRB具有优异的生物安全性和肿瘤靶向性,静脉注射后在雌性小鼠体内肿瘤递送效率超过50%,是传统化学合成的FeS@BSA纳米颗粒的17倍。在近红外激光照射下,FeS@SRB杂化物表现出协同的光热-化学动力学效应,增强氧化应激,引发肿瘤细胞铁死亡和凋亡,从而有效抑制皮下和原位肿瘤的生长。这种基于SRB的治疗策略拓展了肿瘤靶向平台和金属硫化物纳米颗粒生物合成的研究,从而增强了肿瘤治疗效果。

有效地将治疗药物输送到肿瘤部位可以显著提高治疗效果,同时最大程度地降低毒副作用。尽管纳米治疗药物可以通过增强通透性和滞留效应等作用在肿瘤部位富集,但各种生理屏障仍然会影响其递送效率。
由于肿瘤微环境的缺氧特性,厌氧菌可以通过自身推进主动靶向肿瘤部位。此外,肿瘤组织中免疫抑制微环境和丰富的营养物质为厌氧菌的定植和增殖提供了理想的环境。此外,这些细菌可以通过直接破坏肿瘤细胞、激活免疫反应和产生抗肿瘤代谢物来抑制肿瘤生长。因此,厌氧菌介导的肿瘤治疗已成为靶向药物递送和联合治疗的多功能平台。然而,厌氧菌介导的肿瘤治疗仍然存在与某些致病厌氧菌株相关的毒性,并且由于各种修饰而导致递送效率降低。为了减轻致病厌氧菌(例如鼠伤寒沙门氏菌、单核细胞增生李斯特菌和希瓦氏菌)的毒性,人们采用了基因改造或表面涂层技术,但这些方法往往同时降低了细菌的厌氧靶向能力。益生菌因其固有的非致病性、自噬诱导特性和免疫调节作用,代表了一种替代策略。然而,减毒细菌和益生菌本身都面临着疗效有限的挑战。为了解决这些局限性,各种化疗药物和功能化纳米材料已被设计到细菌上,以通过各种策略增强其抗肿瘤作用,例如化学偶联(例如酰胺化、原位聚合或点击反应)、物理相互作用(例如静电或疏水相互作用)和生物正交反应(例如代谢标记、配体-受体相互作用和基因工程)等。然而,这些工程细菌疗法仍然受到复杂的制备方法、细菌活力受损、降低的缺氧靶向能力和安全问题等一定程度的限制。
近年来,利用生物体作为生物工厂的原位生物合成技术因其绿色、经济、安全、便捷等优势而备受关注。特别是,该制备工艺可以保护细菌免受刺激性化学药剂的侵蚀,并有望保持其高活性和肿瘤靶向性。如果该生物合成由非致病性细菌介导,将具有优异的生物安全性,并有望成为肿瘤靶向治疗的理想候选药物。硫酸盐还原菌 (SRB) 是一种厌氧微生物,广泛分布于自然界和人类特定的生态位,包括胃肠道、口腔和生殖系统。在正常条件下,这些细菌与人类宿主共存,不会引起感染或疾病。值得注意的是,SRB 具有独特的能力,可以通过其外膜上的细胞色素介导的电子传递将硫酸盐还原为硫化物。生成的硫化物随后可以与环境中的金属离子(例如亚铁离子 Fe2+)反应,合成金属硫化物纳米颗粒 (NPs)。然而,SRB 及其原位生物合成金属硫化物纳米粒子的厌氧靶向能力及其潜在应用仍未得到深入探索。
该研究开发了 FeS NPs-SRB 生物杂化材料,以增强其肿瘤靶向能力,并整合多模式疗法,从而提高治疗效果和安全性。在 Fe2+ 离子存在下,以 SRB 为生物工厂,通过简便的一步生物矿化工艺合成了 SRB 表面的 FeS NPs(称为 FeS@SRB)。所得 FeS@SRB 生物杂化材料经静脉注射后,能够高度选择性地定植和浸润缺氧肿瘤组织,并由于 SRB 优异的生物安全性和厌氧靶向性,能够通过内吞作用进入肿瘤细胞。
FeS@SRB到达肿瘤后,在弱酸性肿瘤微环境中释放Fe2+引发芬顿反应,产生强氧化性的羟基自由基(•OH)杀死肿瘤细胞。在近红外(NIR)激光照射辅助下,FeS NPs的光热效应诱导肿瘤细胞死亡,并进一步增强氧化应激、铁死亡和细胞凋亡。总之,FeS@SRB通过激活芬顿反应和光热效应介导双模式协同治疗系统,显著抑制肿瘤生长。该研究证实SRB和FeS@SRB具有强大的肿瘤靶向性,静脉注射后的递送效率高达50.5%,是传统化学合成的FeS@BSA NPs的17倍。该研究不仅提出了一种非致病细菌驱动的缺氧靶向策略,而且为纳米治疗药物提供了一个绿色生物合成平台,有可能实现高效的肿瘤靶向递送、卓越的生物安全性和增强的治疗效果。
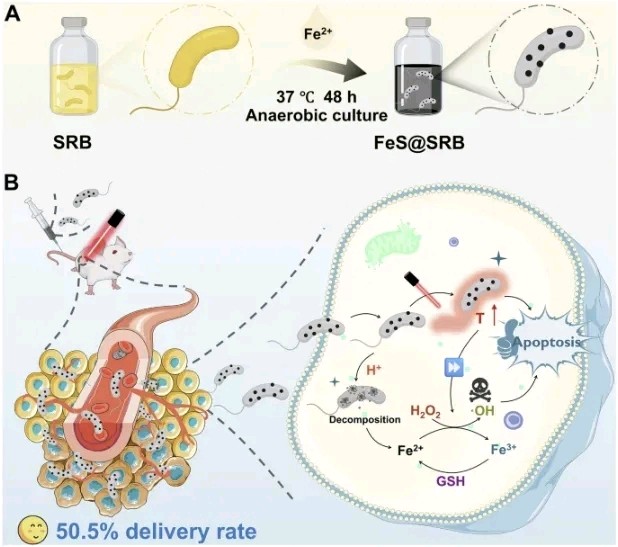
图1 FeS@SR的生物合成及抗肿瘤治疗示意图(图源自Nature Communications)
参考消息:https://www.nature.com/articles/s41467-025-61675-4