
原创 李 斌,姜小清 中国实用外科杂志2025年06月30日 18:30 辽宁
通信作者:姜小清教授
李斌教授
【引用本文】李 斌,姜小清. 肝门部胆管癌根治术关键技术标准及评价[J]. 中国实用外科杂志,2024,44(1):55-60.
肝门部胆管癌根治术关键技术标准及评价
李 斌,姜小清
中国实用外科杂志,2024,44(1):55-60
摘要 肿瘤根治性切除是肝门部胆管癌最为有效的治疗方式,也是肝胆外科最具挑战性的技术领域。合理有效的术前准备方案以及规范的手术方案,是实现高质量肝门部胆管癌根治性切除的必要条件。肝门部胆管癌外科治疗涉及多个核心环节,包括肿瘤可切除性和肝储备功能评估、术前准备、手术操作及术后并发症处理等。有效的术前准备包括无创性影像学检查、胆道引流、肝体积测量、选择性门静脉栓塞术等,目的是减少高胆红素血症的影响、改善肝功能、确保大范围肝切除安全性。围肝门解剖、肝切除范围、门静脉切除重建、肝动脉切除重建、区域淋巴结清扫范围等是肿瘤根治性切除关键技术,目的是实现所有切缘阴性,彻底清除肿瘤及其侵袭的组织。肝门部胆管癌外科治疗仍存在诸多争议点,如术前胆道引流途径及周期、肝切除范围、肝动脉重建的必要性、淋巴结清扫数目等,仍有待进行更多临床研究以形成共识。
基金项目:上海市科委“科技支撑-西医引导类项目”基金项目(No.19411967000)作者单位:海军军医大学第三附属医院(上海东方肝胆外科医院)胆道一科,上海 200438通信作者:姜小清,E-mail:jxq1225@VIP.sina.cn 肝门部胆管癌的外科治疗涉及肿瘤可切除性和肝储备功能评估、术前准备、手术操作及术后并发症处理等多个核心环节,是肝胆外科技术含量和诊疗路径最为复杂的领域。目前国内外学界对梗阻性黄疸肝切除术前肝储备功能评估方案、术前合理胆道引流方式及周期、合理肝切除方案、受侵肝动脉切除后重建的必要性,以及预后生存核心风险因素等关键问题仍未达成广泛共识,因此,多部诊疗指南尚未就肝门部胆管癌外科方案、临床路径形成一致推荐意见。笔者梳理胆管癌国内外指南、专家共识以及相关研究进展,对肝门部胆管癌外科术前准备和肿瘤根治性切除涉及的关键技术进行总结。
1 术前准备关键技术
1.1 肿瘤可切除性评估 CT、MRI、MRCP是评估肿瘤沿胆管径向及横向侵袭生长最为常用的无创性影像学检查手段。有Meta分析报道CT 评估胆管内侵袭生长范围的准确性约为 86%,评估肿瘤侵犯肝动脉的敏感度和特异度分别为83%和93%,评估肿瘤侵犯门静脉的敏感度和特异度分别为89%和92%[1]。MRI对发现肿瘤浸润Glisson鞘膜软组织及毗邻神经更有价值。此外,原发性硬化性胆管炎(primary sclerosing cholangitis,PSC)、IgG4型硬化性胆管炎、胆管良性特发性狭窄、Mirizzi综合征等炎症性疾病导致的胆管狭窄,影像学特点与浸润性胆管癌较相似,MRI能够提供更为丰富的胆管良、恶性疾病鉴别诊断信息[2]。 肝门部胆管癌肿瘤生长部位特殊,限于瘤体多纤维成分并呈浸润性生长为其主要病理特点[3],既往经内镜逆行胰胆管造影(encoscopic retrograde cholangio-pancreatography,ERCP)实施病灶刷检或活检诊断的敏感度有限,难以满足术前诊断及手术方案决策指导的需要[4],因此,术前影像学诊断主要依靠CT/MRI/MRCP等无创性检查手段。随着内镜设备及技术飞速发展,结合ERCP、超声内镜(endoscopic ultrasonography,EUS)[5]、经口胆道子镜光纤直视系统(SpyGlass)[6]等内镜检查手段,近年来胆道肿瘤活检成功率和准确性明显提高[7-8],并且还可提供更为准确的肿瘤侵犯毗邻血管和淋巴结转移信息[9],有望对指导外科手术方案发挥重要的作用。 正电子发射计算机断层显像(PET-CT)作为一种无创性影像学技术,对诊断是否发生淋巴结和远处转移信息价值较高。但肝门部胆管癌发生远隔部位转移相对少见,淋巴结转移多局限于区域淋巴结,PET-CT也难以实现精确界定胆管内肿瘤生长范围以指导手术方案的制定,因此,多部指南并未推荐术前常规实施[10-11]。 需要强调的是,由于胆管癌具有沿胆管壁浸润性生长、病灶境界相对不明的病理特点,实施经皮肝穿刺胆道引流(percutaneous transhepatic biliary drainage,PTBD)、内镜下胆道引流(endoscopic nasobiliary drainage,ENBD)胆道引流后,引流后会使非肿瘤生长区域胆管壁发生炎症,进而影响CT或MRI准确评估胆管肿瘤浸润性生长的范围。因此,无创性影像学检查应在胆道引流前进行,避免有创性检查及治疗措施对决策外科手术方案带来的干扰。
1.2 大范围肝切除可行性评估 Bismuth-Corlette Ⅲ~Ⅳ型肝门部胆管癌多需要联合大范围肝切除以实现肿瘤根治性切除,但高胆红素血症会显著降低病人肝功能耐受大范围肝切除的能力,因此,需要术前对病人肝储备功能作出评估。同样是由于高胆红素血症的干扰,目前尚无学界广泛接受、标准的高胆红素血症状态下肝切除术前肝储备功能评估方案,多是通过梗阻性黄疸解除后肝功能改善状况、肝切除范围等因素综合研判,涉及胆道引流、肝体积测量、选择性门静脉栓塞术(portal vein embolization,PVE)等多个技术方案。 术前胆道引流无疑将会明显降低高胆红素血症状态下肝切除的风险,但对于肝门部胆管癌围手术期和远期生存的利、弊始终存在争议[12]。欧美等指南推荐肝门部胆管癌术前实施胆道引流,但并无明确的引流途径及方案推荐意见[11]。日本《肝胆胰外科协会指南(第3版)》推荐肝门部胆管癌首选ENBD途径胆道引流,实施联合肝切除方案者术前血清总胆红素应≤ 50 μmol/L[13]。 由于肝门部胆管癌发病隐匿,病人就诊时多已出现明显的高胆红素血症,因此寻求术前较低水平血清总胆红素,意味着病人多需经历较久的术前准备周期。不同于上述日本指南推荐的术前胆道引流途径及“长周期”引流方案,笔者团队建立了首选计划保留侧肝叶进行PTBD的“短周期”(3~4周内)胆道引流方案,将术前血清总胆红素≤ 85 μmol/L作为肝储备功能可耐受大范围肝切除的标准,并且重视术前胆汁回输对加速肝功能恢复、改善营养及免疫状态的重要意义。笔者团队临床实践证明,相比较ENBD引流途径,PTBD 导致的胆管炎等并发症风险更低,在相对更短的引流周期内PTBD并不会显著增加肿瘤播散风险;如果实施ENBD引流方案,应同时进行双侧肝叶胆管引流以避免胆管炎风险[14-15]。笔者发现,PTBD“短周期”胆道引流联合胆汁口服回输方案,有助于缩短术前准备周期,降低体液失衡的风险和胆管炎、肝脓肿的发生率,以及规避引流周期过久可能导致肿瘤进展的风险,病人对治疗方案的依从性也更好。 PVE技术已广泛应用于因大范围肝切除、计划残余肝体积过小的术前准备领域[16-17]。研究已证实肝切除术后门静脉压力升高与术后肝衰竭、凝血功能损害显著相关[18]。笔者认为,PVE有助于使计划残余肝叶在术前即预适应血供的动力学变化,降低大范围肝切除术后残余肝叶急剧门静脉血供和压力改变引发的肝衰竭风险。荷兰的一项肝切除临床研究发现,PVE术后3周时计划残余肝叶体积增长的同时肝功能也明显得到强化,并且肝功能强化响应率超过了肝体积增长反应率[19]。笔者团队的临床实践也表明,术前的胆道引流后肝功能改善速率(3~4周内)以及PVE后肝体积增生速度(3周),可以作为肝门部胆管癌大范围肝切除术前肝储备功能核心评估内容[14]。 肝门部胆管癌术前实施PVE的指征并无确切的标准,在《日本肝胆胰外科协会指南(第3版)》中推荐适用于计划肝切除体积/肝脏总体积比≥50%~60%的病例[13]。在笔者团队建立肝门部胆管癌“计划性肝切除”外科治疗路径中,经过术前“短周期”胆道引流后血清总胆红素降至≤85 μmol/L,决策是否PVE的指征为计划肝切除/肝脏总体积比≥50%[14]。由于肝门部胆管癌进展相对缓慢,部分Bismuth Corlette Ⅲ~Ⅳ型病例会发生肝叶萎缩现象[20],因此,笔者团队术前常规进行影像学肝体积测量[14]。
2 肿瘤根治性切除关键技术
2.1 肿瘤根治性切除定义 病理诊断手术标本达到所有切缘阴性(pR0切缘)方可定义为肿瘤根治性切除,肝门部胆管癌pR0切缘尚未获得明确定义。既往多项研究报道将显微镜下胆管切缘无瘤作为实现肿瘤根治性切除的病理诊断标准(pR0>0 mm)[21],其预后也显著优于肉眼胆管切缘阴性、但显微镜下可见肿瘤细胞者(pR1切缘)[22-23],但研究发现胆管宽切缘(pR0>5 mm)在改善预后方面并未明显优于窄切缘(pR0≤5 mm)[24],这可能与胆管癌多呈现浸润癌生长的病理特点有关,仅仅实现胆管无瘤切缘并不能确保病人生存显著获益。因此,国际癌症报告协作组织(international collaboration on cancer reporting,ICCR)建议,pR0切缘应定义为沿胆管径向及横向≥1 mm的组织病理检测均为显微镜下肿瘤阴性[25]。瑞典卡罗琳斯卡大学医院对68例肝门部胆管癌手术标本病理研究结果发现,当无瘤切缘定义为≤1 mm时pR0 切除率为66%,而当无瘤切缘定义扩大为肿瘤至所有切缘距离≥1 mm时pR0切除率降至16%[26]。回顾肝移植治疗肝门部胆管癌的研究历程,也有助于从胆管癌生物学根治性切除的视角,理解重视肝门区域清扫范围的必要性。 在肝移植方案治疗肝门部胆管癌的早期阶段,肝移植术后1 年生存率可达72%,3年和5年分别为35%和23%[27-28]。美国梅奥医学中心建立并报道了一种分期系统(Mayo staging system)以指导肝门部胆管癌临床治疗路径[29-30],其中接受积极新辅助治疗和肝移植方案的病例术后 1、5和10年生存率分别达到91%、69%和62%[31]。梅奥方案体现出严格的诊断、分期、入选标准和术前积极的高剂量放、化疗,能够显著改善肝门部胆管癌肝移植的治疗效果[32]。多中心回顾性对照研究结果也显示,无淋巴结及远隔转移、但局部不可切除的肝门部胆管癌给予新辅助放化疗联合肝移植治疗,术后5年无瘤生存率明显优于常规手术pR0切除队列(62.0% vs. 32.0%)[33]。 上述病理及临床研究结果显示,胆管肿瘤周围内脏腹膜、软组织筋膜及脂肪等组织隐匿的侵袭性癌细胞,可能是影响手术预后的重要因素。因此,评价常规肿瘤根治术是否达到肿瘤pR0切除,不应仅仅是确定胆管切缘镜下无瘤即可,还应彻底清扫肝十二指肠韧带至肝门区域软组织,实现门静脉和肝动脉的骨骼化,手术标本病理分析也需作到规范化、标准化取材和处理流程,以实现提高病理诊断准确率[26]。 限于肿瘤胆管内侵袭性生长的特点,仅凭术者的视觉、触觉有时难以准确判断肿瘤与正常胆管的边界,因此,术中快速病理检测以明确胆管切缘性质非常重要[34]。但日本的一项研究发现,术中病理冰冻证实胆管切缘pR1而后再次切除胆管获得继发性pR0切缘的手术队列,与pR1切缘手术队列的无瘤生存、总生存期差异并无统计学意义,两队列预后均劣于初始切缘即为pR0切缘的队列[35],提示术中保持胆管肿瘤的完整性对预后具有重要意义。笔者团队对Bismuth-Corlette Ⅲ~Ⅳ型病例的手术流程,常规采取以下措施:(1)由足侧至肝门侧的肝十二指肠韧带骨骼化淋巴结清扫。(2)控制或离断肝脏入肝及出肝血流。(3)离断肝实质。(4)扩大显露计划离断胆管支所在的(左或右)肝门空间,最后完成肝门区域胆管离断及切缘活检,以尽可能一次性获得肿瘤阴性胆管切缘[36]。 肝门部胆管癌肿瘤浸润性生长至胰腺段胆管者相对少见。对于术前评估肿瘤生长至胰腺段胆管,或术中病理提示胆管远端切缘阳性者,需扩大胆管切除范围,甚至需联合胰十二指肠切除术(hepatopancreaticoduodenectomy,HPD)。由于肝门部胆管癌主要以肿瘤局部进展为主要病理表现,发生远隔部位转移者较少,因此,HPD并非手术绝对禁忌证,但决策HPD需要在充分考虑病人年龄、身体状况、基础疾病状况、营养状况等因素后,对手术风险与治疗获益进行充分评估后选择能够耐受重大手术打击的病例酌情实施[13,37]。
2.2 围肝门解剖技术要点 肝门部胆管癌根治性切除需要实现胆管及毗邻肝脏、血管、软组织等多切缘阴性,因此,围肝门解剖是肝门部胆管癌根治术的关键技术。Neuhaus等[38]建立肝右三叶切除联合门静脉切除术式,认为肝门无接触整块切除更符合肿瘤外科理念,但多中心回顾性资料分析此类术式围手术期死亡率高、且生存期并未显著获益[39],因此,不作常规推荐。 肿瘤侵犯毗邻门静脉、肝动脉是决策手术方案的重要考量因素,因此,明确血管是否受肿瘤侵犯又是围肝门解剖的重要内容,通过“Glisson鞘内游离”可实现肝门区域血管探查、以决策继续执行或调整术前既定手术方案的目标。根据肿瘤病理生长特点和肝门区域胆管、门静脉、肝动脉空间解剖特点,采取“降低肝门板”的围肝门解剖入路可能会增加术区出血影响视野以及肿瘤播散的风险,因此,笔者更为推荐“离断远端胆总管、上提牵引胆管、充分游离显露肝门胆管后壁空间”的解剖入路。随着胆管肿瘤与肝动脉(特别是肝右动脉)、门静脉汇合部逐步分离,解剖空间进一步扩大,不仅有助于获得更为清晰的肿瘤生长、侵及范围的信息,更有助于在离断肝脏和胆管前,进行肝十二指肠韧带骨骼化清扫、切除肝叶前充分控制或离断入肝血流、确切断离门短静脉,以及高质量的血管切除、重建术等手术操作[36,40]。
2.3 肝切除范围 联合大范围肝切除对肝门部胆管癌手术意义始终存在临床争议[41-45],目前欧美、中、日等国家和地区的多个胆管癌指南或专家共识多推荐Bismuth-Corlette Ⅲ~Ⅳ型肿瘤应联合半肝及以上范围的肝切除,无血管侵犯的Bismuth-CorletteⅠ~Ⅱ型肿瘤无需联合大范围肝切除(Ⅰ型行胆管肿瘤切除术,Ⅱ型建议联合尾状叶切除术)[10-11,13,46]。笔者团队对术前评估肝储备功能无法耐受大范围肝切除的Bismuth-Corlette Ⅲ型及部分Ⅳ型病例,采取中肝叶限制性切除方案以实现合理控制手术损伤。此外,由于术前影像学检查难以准确判别肿瘤侵及尾状叶胆管支,笔者认为Bismuth-Corlette Ⅰ~Ⅱ型可采取围肝门限制性肝切除方案,有利于扩大肝门区域显露范围、降低联合尾状叶切除的难度、彻底清除肝门区域软组织及获得更宽的胆管无瘤切缘,可能是更为合理的手术决策。
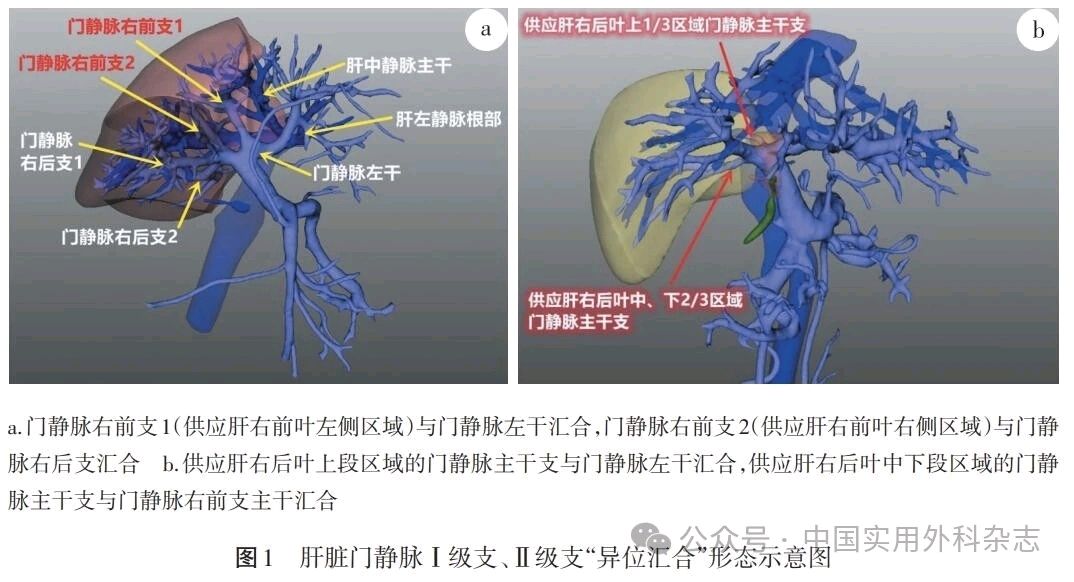
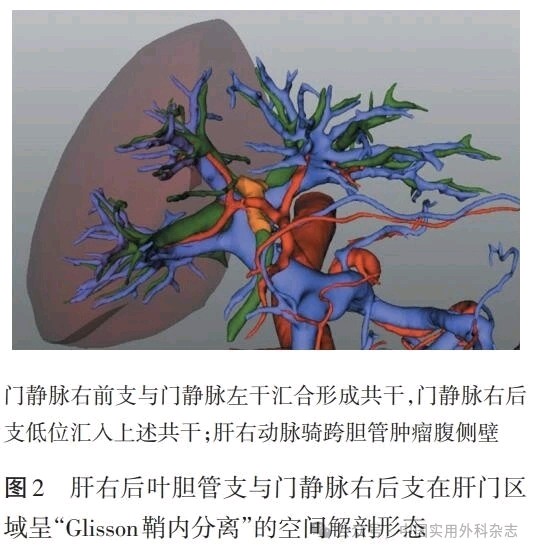
2.4 门静脉切除、重建 联合受侵门静脉切除、重建的积极意义已得到多个研究结果证实[14,47-49],多个指南对联合门静脉切除、重建的临床价值并无异议[10-11,13,46]。需要强调的是,术前不仅需要了解病人是否存在相对少见的门静脉Ⅰ、Ⅱ级分支汇合形态(图1),更需了解门静脉与胆管是否具有特殊的空间位置关系(图2),上述解剖学信息对决策门静脉、胆管断离部位及肝组织离断范围、断面位置极为重要。术前薄层CT扫描及三维可视化影像学重建资料,有助于提供全面、详细的信息[50]。
2.5 肝动脉切除、重建 肝门部胆管癌易侵犯肝动脉、特别是肝右动脉,成为影响病人预后极为重要的不良因素。研究发现联合肝动脉切除虽然可以获得更高pR0切除率,但对改善预后的价值远低于门静脉切除重建术,其临床意义尚无得到广泛共识[44,49,51-52],加之肿瘤侵犯、动脉骨骼化清扫等因素导致肝动脉重建难度较大、重建动脉血管长期通畅率较低等因素,不同指南对重建肝动脉的必要性存在相异的意见,2013版中华医学会指南建议应重建肝动脉[46],而日本《肝胆胰外科协会指南(第3版)》并未明确推荐[13]。笔者团队对临床资料回顾性总结发现,肝动脉切除后未重建人群有更高的肝衰竭相关病死率[14],因此,笔者认为对影像学提示肿瘤侵犯肝动脉的病例,术前需重视根据病人个体化腹腔干-肠系膜上动脉系统解剖形态特征[53],权衡不同手术方案的可行性和利弊,考量要点包括:(1)计划残余肝叶体积是否充足、是否存在粗大动脉血供支。(2)计划残余肝叶动脉是否可以进行高质量动脉重建术。(3)当肿瘤侵犯双侧肝动脉支或肝固有动脉、无法重建肝动脉时,是否可行新辅助治疗联合肝移植术。 当术中探查发现肿瘤侵及肝动脉鞘,可能尚具有打开肝动脉鞘、自血管外膜平面剥离肿瘤的机会,但术后应注意警惕术后发生假性动脉瘤及出血,尤需谨慎对高龄病人实施动脉鞘内肿瘤剥离术[54]。如果术中探查发现肿瘤侵犯双侧肝动脉支或肝固有动脉,无法实施动脉重建术,需注意避免游离残余肝叶的肝周韧带、保持韧带内动脉侧支循环的完整性,术后还应严密监控胆汁瘤、肝脓肿的发生。
2.6 区域淋巴结清扫范围 美国癌症联合委员会(AJCC)和国际抗癌联合会(UICC)联合制定的第8版指南(以下称AJCC/UICC指南)规定,pN0期定义为区域淋巴结阴性。如果区域淋巴结检查阴性,但检查的淋巴结数目没有达到要求,仍可归类为pN0期;pN1期定义为1~3枚区域淋巴结转移;pN2期定义为≥4枚区域淋巴结转移。但AJCC/UICC 指南对肝门部胆管癌区域淋巴结范围并未作出明确定义,仅规定手术切除组织内至少需检测到15个以上的淋巴结[55]。日本《肝胆胰外科协会指南(第3版)》则明确定义肝门部胆管癌区域淋巴结包括肝十二指肠韧带内淋巴结(No.12 h、No.12a、No.12b、No.12p、No.12c淋巴结),肝总动脉旁淋巴结(No.8a、No.8p淋巴结)和胰头后上淋巴结(No.13a淋巴结),但对淋巴结清扫数目并未作明确规定和强制要求[56]。
笔者团队术中常规清扫十二指肠乳头平面头侧胰头后方区域至肝门的肝十二指肠韧带及后腹膜软组织,以求彻底切除No.13a、No.8和No.12淋巴结[14],清扫范围并不扩大至十二指肠乳头平面足侧胰头后方区域(No.13b淋巴结)、肠系膜上动脉根部(No.14淋巴结)、腹主动脉周围(No.16淋巴结)区域,术中也并不常规进行上述所有区域的淋巴结活检术。
参考文献(在框内滑动手指即可浏览)
[1] Ruys AT,van Beem BE,Engelbrecht MR,et al.Radiological staging in patients with hilar cholangiocarcinoma: a systematic review and meta-analysis[J].Br J Radiol,2012,85(1017):1255-1262.
[2] Jhaveri KS,Hosseini-Nik H.MRI of cholangiocarcinoma[J]. J Magn Reson Imaging,2015,42(5):1165-1179.
[3] Guedj N.Pathology of cholangiocarcinomas[J].Curr Oncol,2022,26,30(1):370-380.
[4] Navaneethan U,Hasan MK,Lourdusamy V,et al.Single-operator cholangioscopy and targeted biopsies in the diagnosis of indeterminate biliary strictures: a systematic review[J].Gastrointest Endosc,2015,82(4):608-614.
[5] Weilert F,Bhat YM,Binmoeller KF,et al.EUS-FNA is superior to ERCP-based tissue sampling in suspected malignant biliary obstruction: results of a prospective, single-blind, comparative study[J].Gastrointest Endosc,2014,80(1):97-104.
[6] Ogawa T,Ito K,Koshita S,et al.Usefulness of cholangioscopic-guided mapping biopsy using SpyGlass DS for preoperative evaluation of extrahepatic cholangiocarcinoma: a pilot study[J].Endosc Int Open,2018,6(2):E199-E204.
[7] Okada H,Uza N,Matsumori T,et al.A novel technique for mapping biopsy of bile duct cancer[J].Endoscopy,2021,53(6):647-651.
[8] Bang JY,Krall K,Varadarajulu S.Single-operator cholangioscopy-guided biopsy of indeterminate bile duct strictures: Work in progress[J].Dig Endosc,2021,33(5):873-874.
[9] Kawashima H,Ohno E,Ishikawa T,et al.Endoscopic management of perihilar cholangiocarcinoma[J].Dig Endosc,2022,34(6):1147-1156.
[10] 中国抗癌协会.肝门部胆管癌规范化诊治专家共识(2015)[J]. 中华肝胆外科杂志,2015,21(8):505-511.
[11] Fong ZV,Brownlee SA,Qadan M,et al.The Clinical Management of Cholangiocarcinoma in the United States and Europe: A comprehensive and evidence-based comparison of guidelines[J].Ann Surg Oncol,2021,28(5):2660-2674.
[12] Ramanathan R,Borrebach J,Tohme S,et al.Preoperative biliary drainage is associated with increased complications after liver resection for proximal cholangiocarcinoma[J].J Gastrointest Surg,2018,22(11):1950-1957.
[13] Nagino M,Hirano S,Yoshitomi H,et al.Clinical practice guidelines for the management of biliary tract cancers 2019: The 3rd English edition[J].J Hepatobiliary P……
……。