
医学故事.健康 中华医学会理事 神经外科教授
在生物医药领域,mRNA疗法一直是对抗多种疾病的 “希望之星”。随着mRNA疫苗在抗击疫情中大放异彩,承载mRNA的脂质纳米颗粒(LNP)也成为科研界关注的焦点。最近,康奈尔大学Shaoyi Jiang团队发表在《nature materials》的研究成果,堪称mRNA技术领域的一次重大飞跃——他们找到了聚乙二醇(PEG)的理想替代品,为mRNA技术的发展打开了全新局面!

传统难题:PEG在mRNA疫苗中的 “双面性”
在传统的mRNA疫苗或药物递送过程中,LNP是非常关键的 “运输工具”,而PEG则是LNP配方里不可或缺的成分。过去,PEG凭借独特的优势,在各类获批药物中广泛应用。它就像给生物制剂穿上 “隐身衣”,能掩盖制剂的免疫原性,延长药物在血液中的 “存活时间”。在LNP系统中,PEG的作用同样重要,既能防止纳米颗粒在制作和储存时 “抱成团”,又能让LNP在体内更稳定,不被免疫系统轻易 “发现” 并清除。
PEG也有明显的缺点:它带来的空间位阻会严重阻碍mRNA进入细胞,还会影响mRNA从内体中 “逃脱”,这大大降低了mRNA-LNP的工作效率。更令人担忧的是,近年来研究发现,LNP-mRNA疫苗引发的过敏反应,很可能与PEG的免疫原性有关。而且在小鼠实验中,多次使用含PEG的LNP后,会出现加速血液清除(ABC)效应,导致疫苗效果变差。所以,寻找替代PEG-lipids的材料,成了科研人员急需解决的难题。
创新突破:PCB-lipids闪亮登场
面对这一挑战,康奈尔大学的研究团队成功合成了聚羧基甜菜碱(PCB-共轭脂,PCB-lipids),用来替代LNP系统中的PEG-lipids。PCB其实并非 “新面孔”,之前就已应用在基因递送载体领域,用于运输DNA和小干扰RNA(siRNA)。作为从天然甘氨酸甜菜碱衍生出的两性离子聚合物,PCB具有超强的亲水性,这让它拥有出色的 “隐身” 能力。和主要靠氢键与水结合的PEG不同,PCB与水分子之间的静电相互作用,使其水合性能更出色。
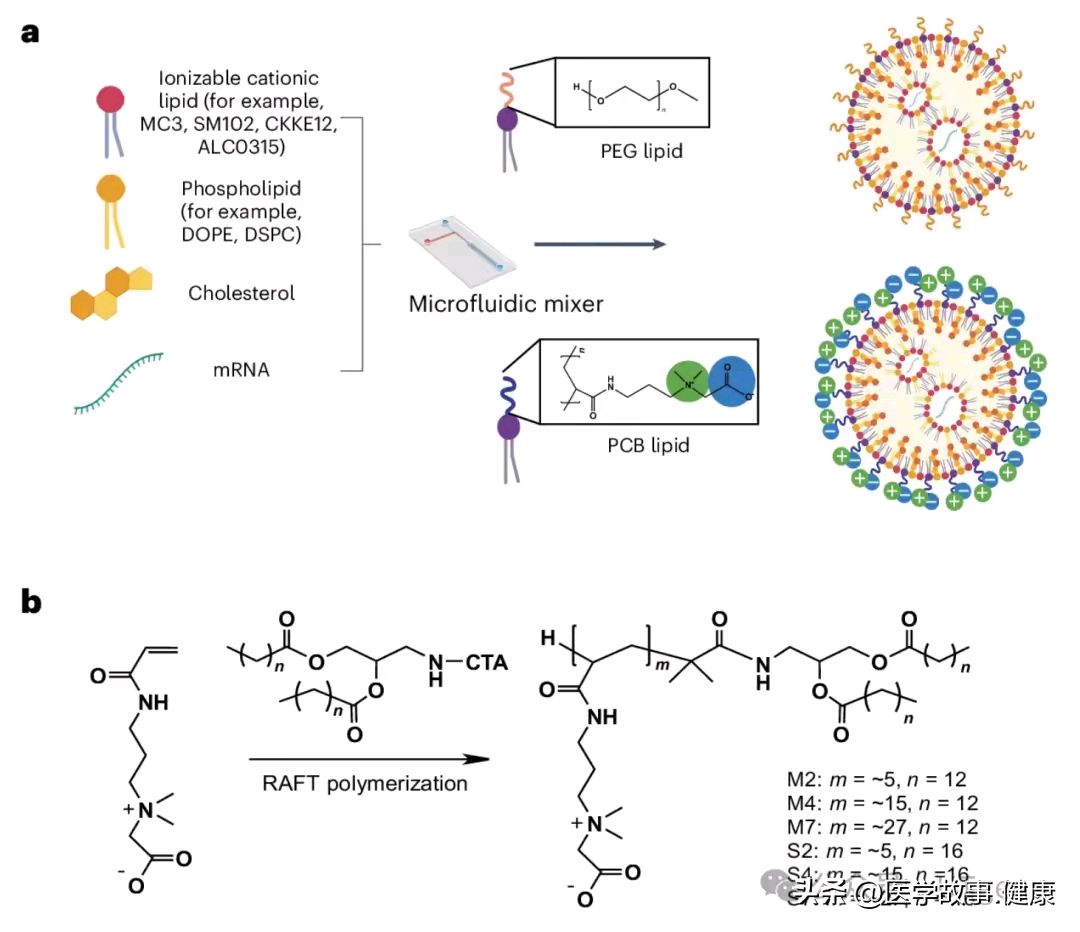
研究团队对PCB-lipids在LNP系统中的结构和比例进行了全面分析,结果令人惊喜:PCB-lipids适应性很强,能在各种LNP系统中高效运输mRNA,展现出巨大的应用潜力。
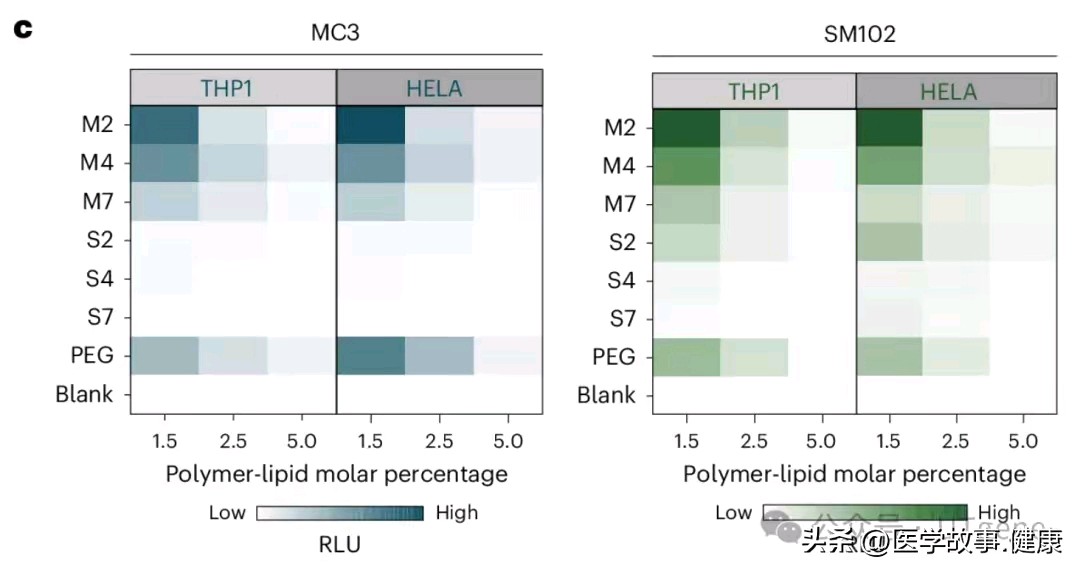
实力展示:PCB-LNPs的卓越表现
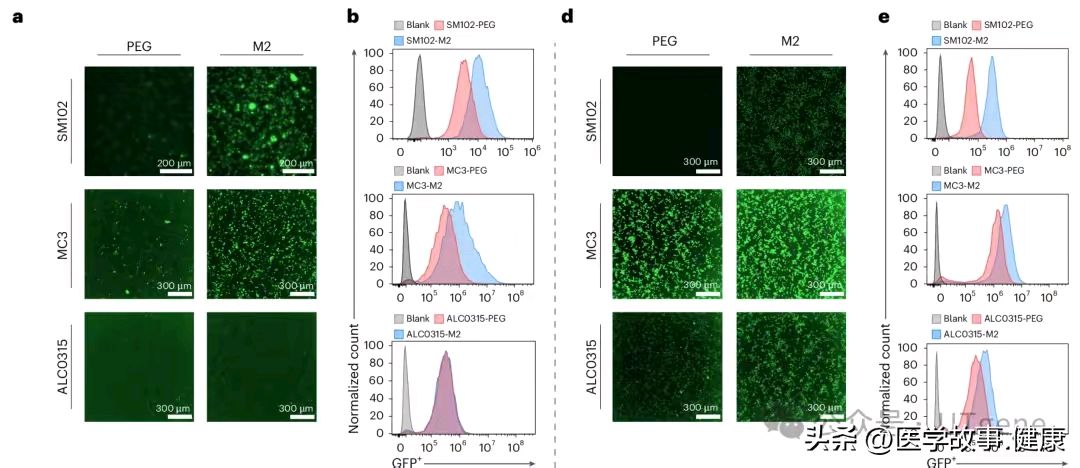
研究人员通过一系列严谨实验,对比了PCB-LNPs和PEG-LNPs的转染效率。在多种细胞系和LNP系统测试中,PCB-LNPs都表现得十分出色。不管是用荧光素酶报告基因检测,还是通过增强绿色荧光蛋白(eGFP)在单个细胞层面观察,PCB-LNPs的成绩都远超PEG-LNPs。
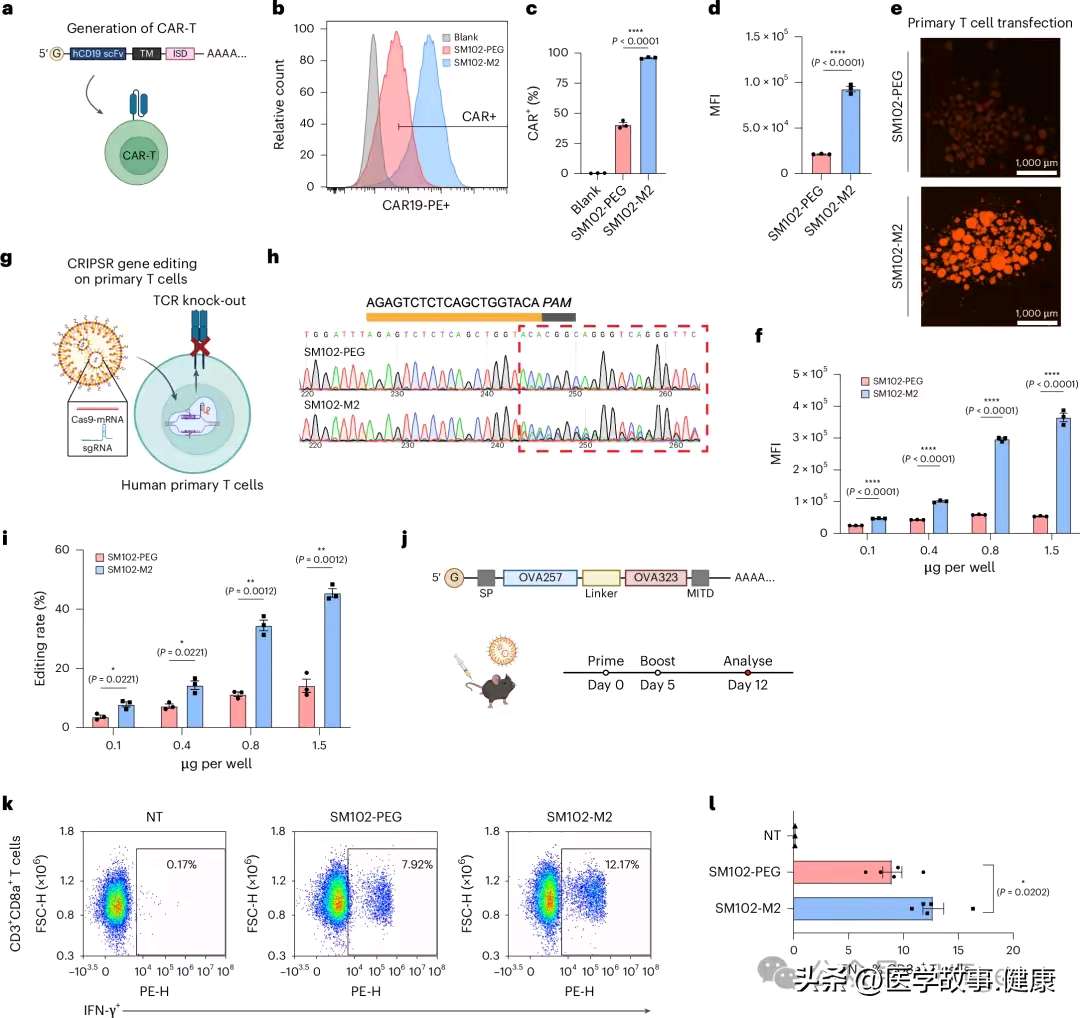
在多种重要应用方面,比如制备CAR-T细胞、进行基因编辑等,PCB-LNPs同样表现优异,实现了更高的蛋白表达和更高效的基因操作。在癌症疫苗研究中,以卵清蛋白(OVA)为模型抗原对小鼠进行实验,结果显示,使用PCB-LNPs的小鼠在受到抗原刺激后,产生的抗原特异性免疫反应更强,这意味着PCB-LNPs在癌症免疫治疗等领域前景广阔。
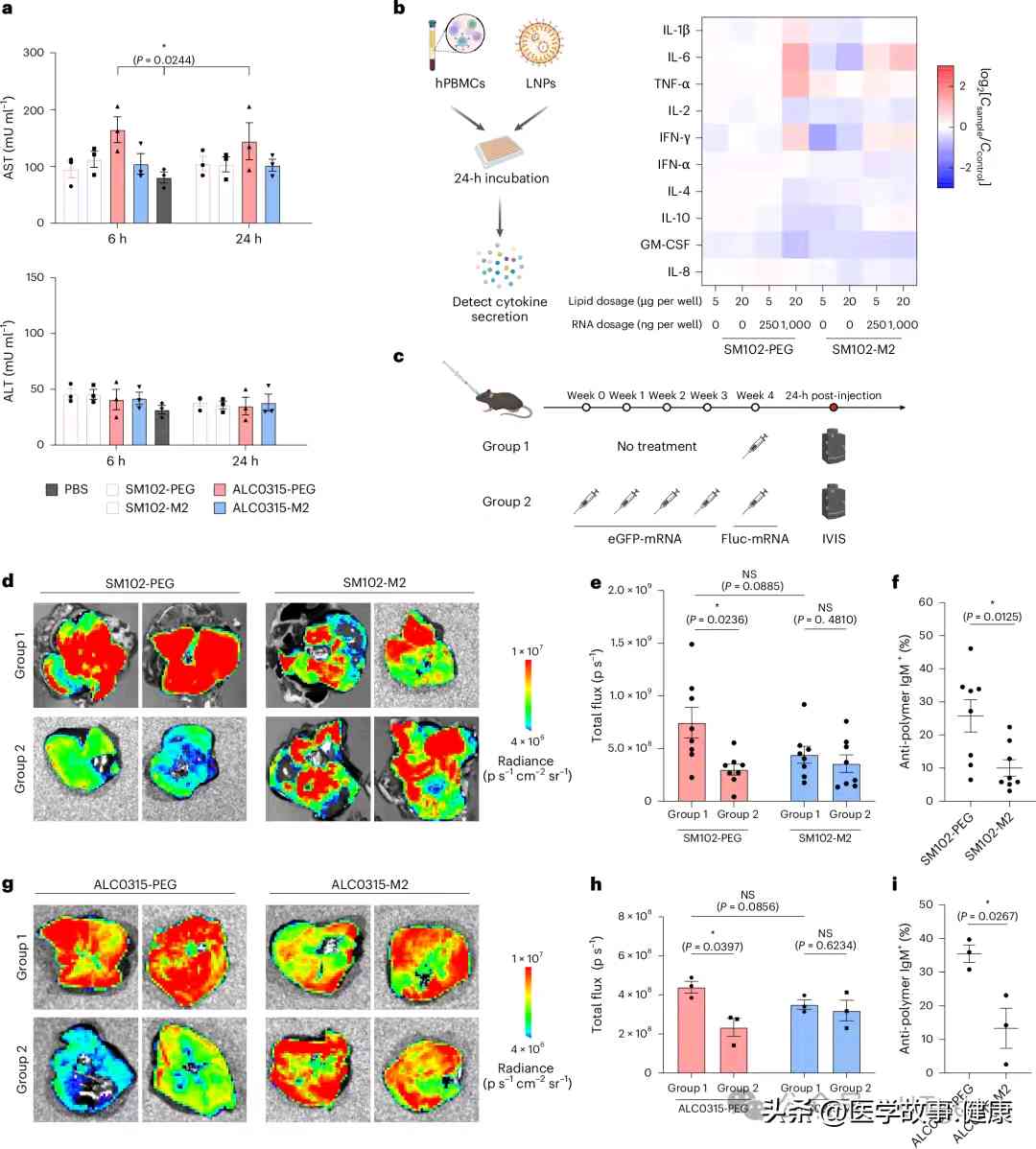
安全性和免疫原性是衡量LNP新配方能否应用于临床的关键。实验数据显示,PCB-LNPs的肝毒性非常低,对肝脏几乎没有影响。在免疫原性方面,与PEG-LNPs相比,PCB-LNPs刺激人体外周血单个核细胞(hPBMC)时,引发的炎症因子水平更低。更值得一提的是,多次给药实验中,PEG-LNPs会诱导人体产生抗PEG抗体,引发ABC效应,导致递送效率降低;而PCB-LNPs基本不会出现这种情况,能始终保持稳定的递送效率,为临床多次给药治疗提供了可靠保障。
未来展望:mRNA疗法的新征程
这项研究成果意义重大,PCB-LNPs凭借更高的转染效率、更优的内体逃逸能力和更安全的免疫原性,为mRNA疫苗及其他mRNA疗法的临床应用提供了坚实可靠的技术平台。