
一次外泌体等于100次水光针?外泌体可以通过单一成分发挥多种效果,使其成为临床应用的多功能和有前途的选择
干细胞 2025年06月24日 11:31
撰文: 海军军医大学 鹌鹑
本文审核专家:江苏大学附属医院 李晶教授
有人说一次外泌体等于100次水光针,并且这样的说法屡见不鲜。那么,外泌体对于皮肤的改善到底有着什么样的作用呢?皮肤老化的改善是当下最受关注的议题,科学研究表明间充质干细胞衍生的外泌体(MSC-exos) 已成为一种很有前途的选择,为皮肤抗衰老提供了多方面的好处。
本文通过汇总已经发表的文献,盘点间充质干细胞外泌体对抗皮肤老化的作用及潜力:(1) 抗炎与免疫调节
(2) 促胶原蛋白合成和重塑
(3) 促进血管生成MSC-exos
通过 PI3K/Akt 和 Notch 信号传导等分子途径增强胶原蛋白合成、调节炎症并促进血管生成。此外,外泌体能够将生物活性分子精确地输送到目标细胞,这凸显了其在皮肤修复和抗衰老应用中的潜力。此外,这些纳米级细胞外囊泡表现出卓越的生物利用度、生物相容性和免疫调节特性,解决了传统皮肤抗衰老难题。
皮肤是人体最大的器官,它的厚度范围从最薄的 0.1 毫米到最厚的 1.5 毫米。
皮肤老化是一个动态的多因素过程,受遗传易感性、荷尔蒙变化和外部压力源(如紫外线照射、环境污染物和生活方式行为)的影响。这种进展表现为表皮增厚、斑驳变色、深皱纹、松弛、暗沉和质地粗糙等。
PubMe上的大量研究探讨了氧化应激、紫外线 (UV) 辐射和炎症等因素对皮肤老化的影响。这些研究表明,胶原蛋白和其他细胞外基质 (ECM) 成分退化,导致皱纹和皮肤弹性丧失。
皮肤具有天然的自愈能力,涉及一连串的过程,例如止血、炎症、增殖和组织重塑。然而,当这种愈合过程被中断、改变或延长时,伤口愈合可能会延迟,或者可能会出现慢性伤口。
虽然现有的抗衰老疗法(从局部制剂到微创干预)取得了不同程度的成功,但它们的效果通常是短暂的,并且只针对孤立的症状,而不是潜在的生物学机制。本期文献Exosomes derived from mesenchymal stem cells: A novel agent for skin aging treatment,全面揭示了基于外泌体抗皮肤衰老的新策略。

在再生医学中,与传统的活干细胞疗法相比,源自 MSC-exos 的外泌体具有显著优势。外泌体是细胞释放的纳米级囊泡,源自内体膜的内折叠,并通过与质膜融合释放到体液中。它们作为细胞间通讯的介质,可以定植到靶细胞或激活信号通路。
外泌体含有多种生物分子,包括蛋白质、脂质、核酸和碳水化合物,这些成分赋予它们在生理和病理过程中的关键作用,如免疫反应、细胞增殖等。
近年来,外泌体治疗皮肤异常的潜力得到了广泛的探索。它们的主要优势包括稳定性、抵抗免疫排斥反应以及直接刺激靶细胞的能力。与传统方法不同,外泌体可以通过单一成分发挥多种效果,使其成为临床应用的多功能和有前途的选择。
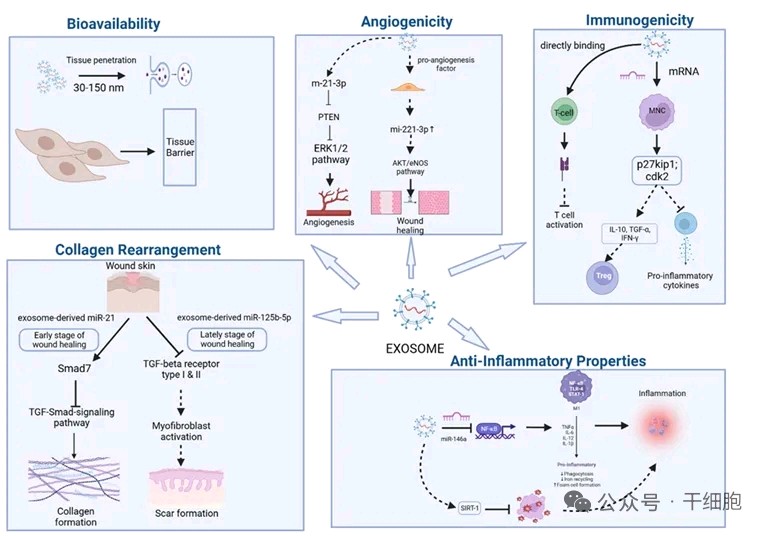
图片引用自文献5
MSC衍生的外泌体在抗皮肤衰老及美容方面展现出巨大的潜力。它们不仅能够调节胶原蛋白重塑、减少炎症,还能够增强血管形成,从而在效果和安全性方面优于传统疗法。抗炎与免疫调节作用
皮肤老化是一个复杂的生物学过程,涉及多种细胞和分子机制。慢性炎症和氧化应激是皮肤老化的主要驱动力之一。随着年龄的增长,皮肤细胞的代谢活动逐渐减弱,自由基的产生增加,导致氧化应激反应加剧。同时,慢性炎症反应也会逐渐累积,破坏皮肤的正常结构和功能。
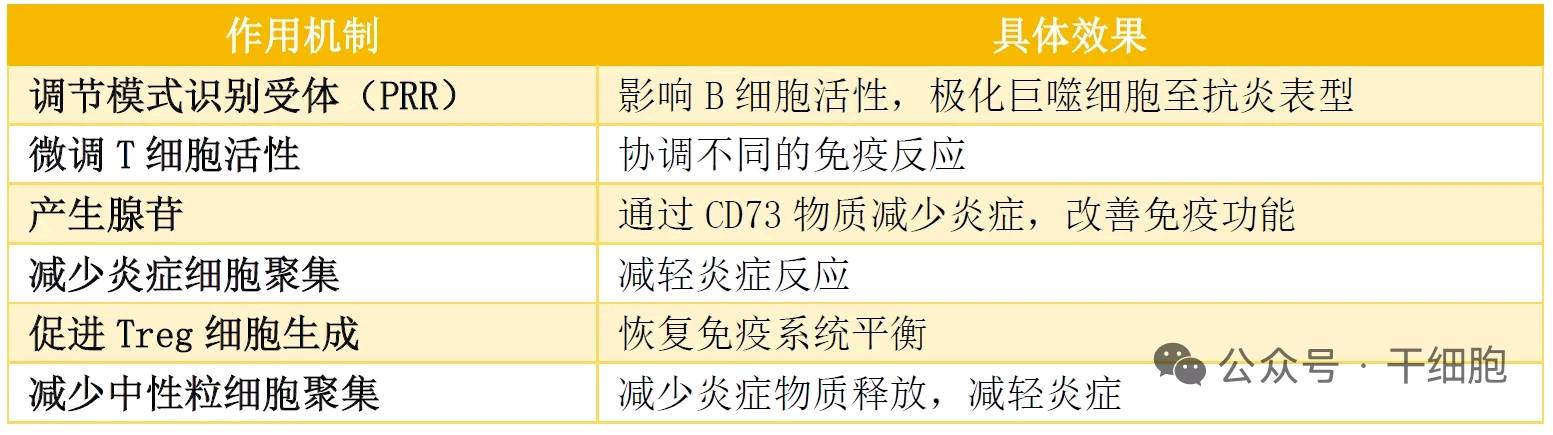
MSC-exos的免疫调节作用表
MSC-Exos在抗炎方面表现出色,它们能够下调促炎细胞因子如IL-1β和TNF-α,并抑制NF-κB通路,从而减轻慢性炎症和氧化应激。此外,MSC-Exos还能增强保护性蛋白如SIRT1和P53的表达,提高皮肤细胞在压力条件下的存活率。促胶原蛋白合成和重塑
在皮肤老化的过程中,胶原蛋白的降解和重塑失衡是导致皮肤松弛和皱纹形成的关键因素。
胶原蛋白是皮肤的主要结构蛋白,其含量和结构的改变直接影响皮肤的外观和功能。随着年龄的增长,胶原蛋白的合成减少,降解加速,导致皮肤的弹性和紧致度下降。
外泌体帮助维持皮肤紧致度
(1)MSC-Exos能够调节胶原蛋白的重塑过程,减少胶原蛋白的降解,从而帮助维持皮肤的弹性和紧致度。
(2)MSC-Exos通过促进成纤维细胞的增殖和分化,增加胶原蛋白的合成,同时抑制基质金属蛋白酶(MMPs)的活性,减少胶原蛋白的降解。促进血管生成
此外,MSC-Exos还能够促进血管形成,改善皮肤的血液循环,为皮肤细胞提供充足的营养和氧气。良好的血液循环不仅有助于细胞的代谢活动,还能够加速皮肤损伤的修复过程。外泌体在血管生成中的作用表
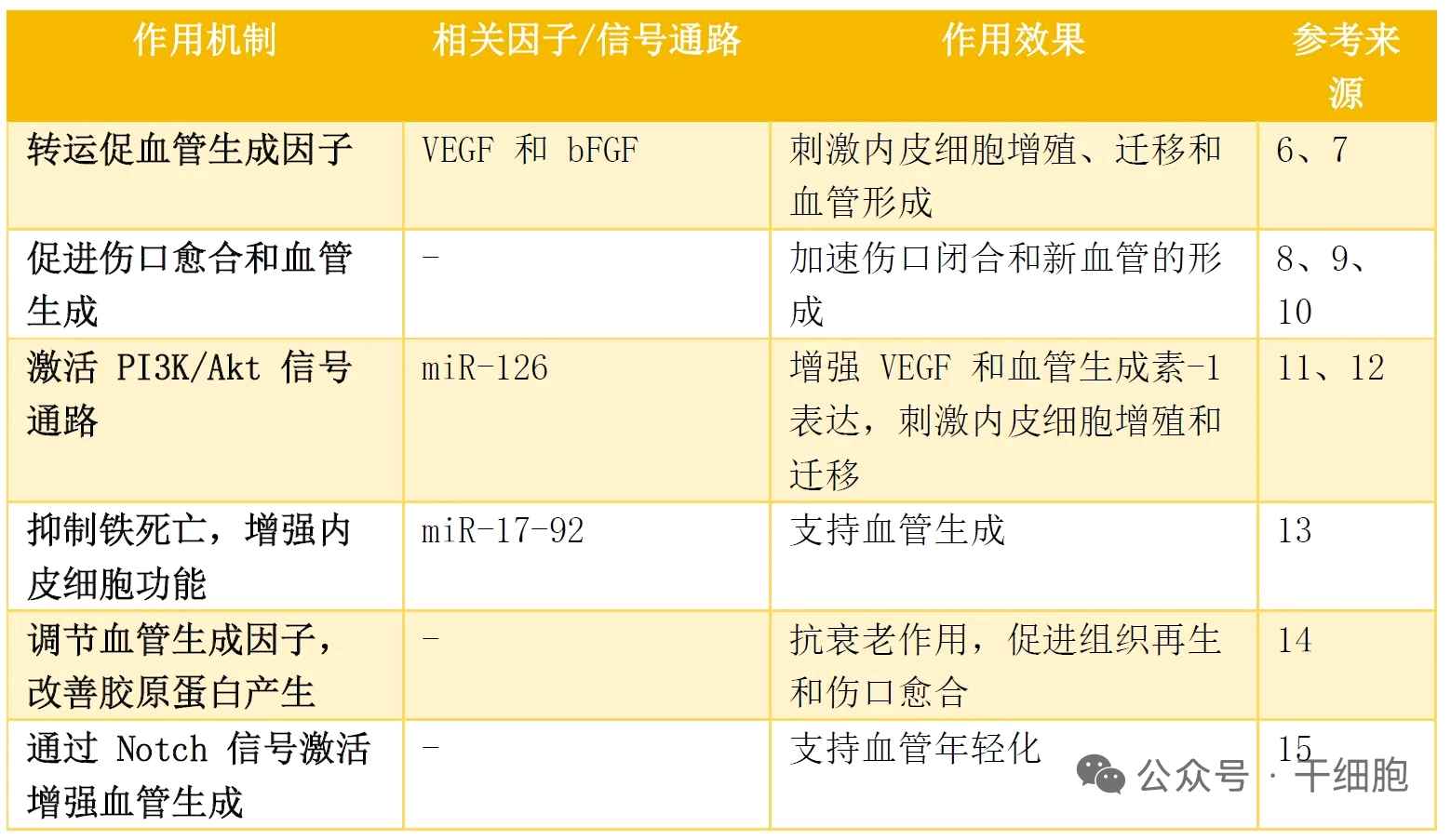
小结
MSC 衍生的外泌体代表了一种对抗皮肤衰老的革命性方法,将再生和免疫调节能力整合到一个平台中。它们调节胶原蛋白重塑、减少炎症和增强血管形成的能力使它们在效果和安全性方面优于传统疗法。未来,外泌体生产工艺的优化、靶向精度的提高等对于释放外泌体的全部潜力至关重要。随着研究的深入和技术的成熟, MSC衍生的外泌体将成为未来抗衰老和美容领域的重要工具。它们不仅为皮肤老化的改善提供了新的思路和方法,也为其他组织器官的再生医学研究提供了宝贵的经验和启示。通过科学家们的不懈努力,间充质干细胞外泌体有望在未来造福更多的人群,带来更加健康和年轻的肌肤。
1. Nedelec B., Forget N.J., Hurtubise T., Cimino S., de Muszka F., Legault A., Skin characteristics: normative data for elasticity, erythema, melanin, and thickness at 16 different anatomical locations. Skin Research and Technology. 2016; 22 (3) : 263-75 .
2. Osmancevic A., Gillstedt M., Landin-Wilhelmsen K., Wennberg Larkö A.M., Larkö O., Holick M.F., Size of the exposed body surface area, skin erythema and body mass index predict skin production of vitamin D. Journal of Photochemistry and Photobiology. B, Biology. 2015; 149 : 224-9 .
3. Green A.C., Hughes M.C., McBride P., Fourtanier A., Factors associated with premature skin aging (photoaging) before the age of 55: a population-based study. Dermatology (Basel, Switzerland). 2011; 222 (1) : 74-80 .
4. Sachs D.L., Varani J., Chubb H., Fligiel S.E., Cui Y., Calderone K., Atrophic and hypertrophic photoaging: Clinical, histologic, and molecular features of 2 distinct phenotypes of photoaged skin. Journal of the American Academy of Dermatology. 2019; 81 (2) : 480-8 .5. Nguyen, S. (2024). Exosomes derived from mesenchymal stem cells: A novel agent for skin aging treatment. Biomedical Research and Therapy, 11(12), 7003-7014. https://doi.org/10.15419/bmrat.v11i12.9466. Ungvari Z., Tarantini S., Kiss T., Wren J.D., Giles C.B., Griffin C.T., Endothelial dysfunction and angiogenesis impairment in the ageing vasculature. Nature Reviews. Cardiology. 2018; 15 (9) : 555-65 .
7. Ribeiro M.F., Zhu H., Millard R.W., Fan G.C., Exosomes Function in Pro- and Anti-Angiogenesis. Current Angiogenesis. 2013; 2 (1) : 54-9 .
8. Liang X., Zhang L., Wang S., Han Q., Zhao R.C., Exosomes secreted by mesenchymal stem cells promote endothelial cell angiogenesis by transferring miR-125a. Journal of Cell Science. 2016; 129 (11) : 2182-9 .
9. Bian D., Wu Y., Song G., Azizi R., Zamani A., The application of mesenchymal stromal cells (MSCs) and their derivative exosome in skin wound healing: a comprehensive review. Stem Cell Research & Therapy. 2022; 13 (1) : 24 .
10. Teng L., Maqsood M., Zhu M., Zhou Y., Kang M., Zhou J., Exosomes Derived from Human Umbilical Cord Mesenchymal Stem Cells Accelerate Diabetic Wound Healing via Promoting M2 Macrophage Polarization, Angiogenesis, and Collagen Deposition. International Journal of Molecular Sciences. 2022; 23 (18) : 10421 .
11. Vu N.B., Nguyen H.T., Palumbo R., Pellicano R., Fagoonee S., Pham P.V., Stem cell-derived exosomes for wound healing: current status and promising directions. Minerva Medica. 2021; 112 (3) : 384-400 .
12. Zhang L., Ouyang P., He G., Wang X., Song D., Yang Y., Exosomes from microRNA-126 overexpressing mesenchymal stem cells promote angiogenesis by targeting the PIK3R2-mediated PI3K/Akt signalling pathway. Journal of Cellular and Molecular Medicine. 2021; 25 (4) : 2148-62 .
13. Pan Q., Wang Y., Lan Q., Wu W., Li Z., Ma X., Exosomes Derived from Mesenchymal Stem Cells Ameliorate Hypoxia/Reoxygenation-Injured ECs via Transferring MicroRNA-126. Stem Cells International. 2019; 2019 (1) : 2831756 .
14. Nie W., Huang X., Zhao L., Wang T., Zhang D., Xu T., Exosomal miR-17-92 derived from human mesenchymal stem cells promotes wound healing by enhancing angiogenesis and inhibiting endothelial cell ferroptosis. Tissue & Cell. 2023; 83 .
Zheng L., Song H., Li Y., Li H., Lin G., Cai Z., Insulin-Induced Gene 1-Enhance Secretion of BMSC Exosome Enriched in miR-132-3p Promoting Wound Healing in Diabetic Mice. Molecular Pharmaceutics. 2024; 21 (9) : 4372-85 .