

疗法简介
TCR - T(T cell receptor - gene engineered T cells)疗法是通过对自身T细胞进行肿瘤抗原特异性TCR基因工程改造,使之能够特异性识别肿瘤细胞并发挥抗肿瘤免疫反应的过继免疫治疗方法,对体内缺乏肿瘤特异性T细胞的患者是一种有效的治疗手段。SCG101是一款全球首创(First in class)针对乙型肝炎表面抗原特异性的自体TCR - T细胞治疗产品,它可以特异性靶向HBV抗原相关T细胞表位,有效清除HBV - HCC肿瘤细胞、HBV - DNA整合的癌前病变细胞和HBV感染细胞。
临床数据
2023年国际细胞和基因治疗大会(ISCT)数据
一名患有HBV相关肝细胞癌患者接受单剂量SCG101治疗后,第28天肿瘤靶病灶相比基线缩小66.1%,达到部分缓解(PR),并在第4个月进一步缩小74.5%;另一处病灶完全消失。数据截止时,肿瘤已保持超过6.9个月没有进展,保持持续缓解状态。此外,治疗前和治疗后的活组织检查显示100%清除了肝脏中的HBsAg + 肝细胞。输注SCG101后,血清HBsAg从基线的557.96IU/mL降至第7天的1.3IU/mL,并在第28天进一步降至0.08IU/mL。
2024年欧洲肝脏研究协会年会(EASL Congress 2024)数据
在6例晚期HBV相关肝癌患者中接受SCG101治疗,以5.0×10⁷~1.0×10⁸/kg TCR + 的T细胞输注,客观缓解率(ORR)为33%,获得部分缓解(PR)的患者均维持缓解超过6个月,其中1例靶病灶完全缓解,且27个月内无进展。6例患者在接受SCG101治疗后均观察到血清HBsAg显著下降,其中有4例患者观察到1~4log₁₀的血清HBsAg显著降低,在长达27个月的随访期间,HBsAg水平保持≤15IU/mL,同时,这4例患者均观察到肿瘤缩小,比没有降低的患者无进展生存期(PFS)和总生存期(OS)显著延长(PFS:5.9 vs 0.7个月,mOS:19.0 vs 6.3个月)。
北京协和医院临床研究数据
该例受试者是54岁男性,2022年7月输注了SCG101。SCG101输注后第28天观察到大面积肿瘤坏死,随后出现部分反应,靶肿瘤病灶分别减少74.5%(mRECIST)和47.5%(iRECIST)。患者病情稳定至少6.9个月,保持持续缓解状态。与HBV特异性T细胞扩增和血清ALT升高相一致,血清HBsAg在细胞移植后1周内从557.96IU/mL大幅迅速下降至1.3IU/mL。第28天,与基线相比的最大降幅从3.84log₁₀至0.08IU/mL,在随访期间均保持在低于1IU/ml的水平(HBsAg阴性)。输注73天后,肝活检中表达HBsAg的肝细胞无法检测到。输注后第3个月,患者接受肝活检,取样标本中未检测到HBsAg表达,提示患者体内的乙肝表面抗原阳性肝细胞已经100%清除。
优势与意义
独特功能
通过生物标志物分析,SCG101展示了独特的CD8/CD4双重功能。输注SCG101后,观察到CD8:CD4比例均衡,表明SCG101触发了强烈的免疫反应。与长期T细胞增殖相关的持续且高比例的干细胞样记忆T细胞(Tscm)支持延长的T细胞功能以及持续的抗肿瘤和抗病毒反应。
治疗前景
此项研究表明,SCG101疗法在单次给药后能够消除乙肝病毒阳性肝细胞并实现持续的肿瘤控制,给中晚期或复发的乙肝肝癌患者提供了新的疗法和希望。目前肝细胞癌的临床治疗方法主要有手术切除、肝移植、栓塞化疗、射频消融等,但存在易复发转移等局限,尤其是肝移植后发生HCC复发的患者,治疗选择会更加有限,而SCG101为这部分患者带来了新的可能。
临床招募信息
目前无癌家园有多项TCR - T疗法的临床试验正在进行招募,急招乙型肝炎病毒相关肝细胞癌患者。此外,若想咨询其他细胞疗法(CAR - T、NK、CAR - NK、CTL、TILs等疗法)的患者,同样可将病理报告及治疗经历、出院小结等资料提交至无癌家园医学部,详细评估病情。

HBV相关肝癌的免疫治疗新进展
外泌体中非编码RNA HDAC2 - AS2调控机制研究
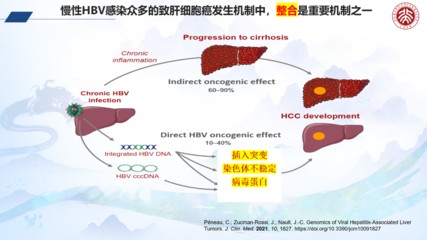
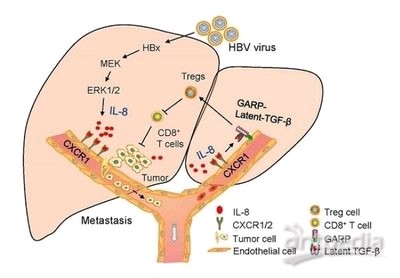
中科院生物物理研究所杨鹏远和陈润生研究组在《Nature Communications》期刊发表研究。我国超80%肝癌患者源于HBV慢性感染,研究表明HBV感染过程中病毒编码抗原可诱导TGF - β信号高度活化,但其调控机制待阐明。研究人员筛选出TGF - β刺激后差异表达最显著的lncRNA——HDAC2 - AS2,发现其虽不影响肿瘤自身生长,但显著促进C57小鼠皮下肿瘤生长。肿瘤细胞中的HDAC2 - AS2可通过外泌体分泌到微环境,HCC患者血浆外泌体中HDAC2 - AS2表达水平更高。外泌体中的HDAC2 - AS2被CD8⁺T细胞摄取后,结合胞内的细胞周期蛋白依赖激酶9(CDK9),使胞内CDK9蛋白水平下降,诱导CD8⁺T细胞耗竭及凋亡,抑制其杀伤功能。多组学分析显示CDK9在CD8⁺T细胞活化和杀伤效应中起关键调节作用。研究团队分析接受ICB治疗肝癌患者的sc - RNA数据库发现,CDK9可增强ICB治疗时CD8⁺T细胞的功能,HDAC2 - AS2高表达的肝癌在PD - 1抗体治疗中更获益。此研究阐明了HBV相关肝癌外泌体中非编码RNA HDAC2 - AS2调控免疫逃逸新机制,有望为HBV相关肝癌提供新的诊疗靶标。
靶向PRP19调节肿瘤浸润B细胞免疫功能研究
复旦大学研究团队在期刊《Advanced Science》发表论文。肝细胞癌(HCC)是肝癌常见类型,肿瘤免疫微环境与HCC恶性行为密切相关,但HCC中B细胞的免疫功能和调节机制尚不清楚。研究人员对高和低B细胞浸润的HCC样本表达差异进行探索,发现抑制PRP19表达促进了肿瘤组织中B细胞浸润,并阻碍了HCC的生长。机制上,PRP19与DDX5相互作用,导致DDX5蛋白的泛素化和降解,减弱的DDX5会破坏CXCL12mRNA的稳定性,通过CXCL12/CXCR4轴抑制B细胞招募和浆细胞分化。此外,在小鼠模型中,采用CXCR4⁺B细胞的过继转移结合CXCL12治疗有效地抑制了HCC的发生,从而重塑了免疫反应。该研究为HCC免疫治疗提供了有价值的见解,可通过靶向PRP19并调节肿瘤浸润B细胞的免疫功能来改善临床疗效。
SCG101治疗的安全性评估
早期临床研究初步结论
在2022年第57届欧洲肝脏研究协会(EASL)年会暨国际肝脏大会(ILC2022)上公布的初步研究数据显示,SCG101在缺乏有效治疗手段的晚期乙肝病毒相关性肝癌患者中展现出良好的安全性。
从临床数据推测安全性
无严重不良事件体现安全性
在2024年欧洲肝脏研究协会年会(EASL Congress 2024)公布的数据里,6例晚期HBV相关肝癌患者接受SCG101治疗,以5.0×10⁷ ~ 1.0×10⁸/kg TCR⁺的T细胞输注后,获得部分缓解(PR)的患者均维持缓解超过6个月,其中1例靶病灶完全缓解且27个月内无进展。在这些描述中未提及严重不良事件,从一定程度上可以推测SCG101治疗具有较好的安全性,能够让患者在较长时间内耐受治疗并获得病情的改善。
免疫反应良好体现安全性
从治疗效果来看,患者接受治疗后出现了肿瘤缩小、血清HBsAg显著下降等积极反应,并且部分患者的无进展生存期和总生存期得到显著延长。这些良好的治疗反应暗示SCG101在发挥治疗作用的同时,并没有因为严重的不良反应而影响治疗进程和患者的生存质量,侧面反映出其安全性较好。

肝癌免疫治疗靶点新发现
KIF20A作为肝细胞癌免疫治疗靶点
靶点确认
方驰华团队通过转录组mRNA测序分析,首次确认Kinesin family member 20A(KIF20A)是肝细胞癌适用的免疫原性抗原。KIF20A作为肿瘤相关抗原(TAA),在肝细胞癌细胞中呈过表达状态,并且与不良预后密切相关。由于其广泛表达和免疫原性,KIF20A可能成为肝细胞癌疫苗开发的理想靶点。
基于靶点的疫苗研究
基于这一发现,研究团队创新提出了一种KIF20A热敏水凝胶疫苗(K/RLip)。该疫苗在体外展现了优异的树突状细胞激活效果,进而显著增强T细胞对肿瘤细胞球的浸润。通过免疫人源化的PDX模型,验证了疫苗的在体抗肿瘤效果。此外,K/RLip与PD - L1抑制剂联合使用可有效抑制肝细胞癌(HCC)生长,同时无明显体重下降及组织毒性,血清生物化学指标无明显变化,说明疫苗具有较好的生物安全性。这一研究成果为HCC免疫治疗提供了新的策略。