
医学故事.健康 中华医学会理事 神经外科教授
J Transl Med. 2023 Jun 8;21(1):372.doi: 10.1186/s12967-023-04218-z.
Exploring the molecular mechanism of comorbidity of autism spectrum disorder and inflammatory bowel disease by combining multiple data sets
Jinyi Zhu 1, Haoran Meng 1, Li Zhang 2, Yan Li 3
摘要:自闭症谱系障碍(ASD)作为一种神经发育障碍以及炎症性肠病(IBD)这一常见的慢性消化系统疾病,二者之间被发现存在潜在关联,然而其病理生理机制尚不明确。本研究聚焦于利用生物信息学工具探究二者差异表达基因(DEGs)背后的生物学机制,通过多种分析方法确定了相关的共同差异表达基因、关键基因以及涉及的生物学通路等,揭示了二者共有的发病机制,这些共同的关键基因有望为后续进一步的机制研究及新疗法开发提供靶点。本文旨在详细阐述二者共病机制相关研究进展,包括背景、具体研究方法、取得的成果以及潜在意义等方面,为该领域深入研究提供参考。
自闭症谱系障碍与炎症性肠病共病的分子机制研究进展
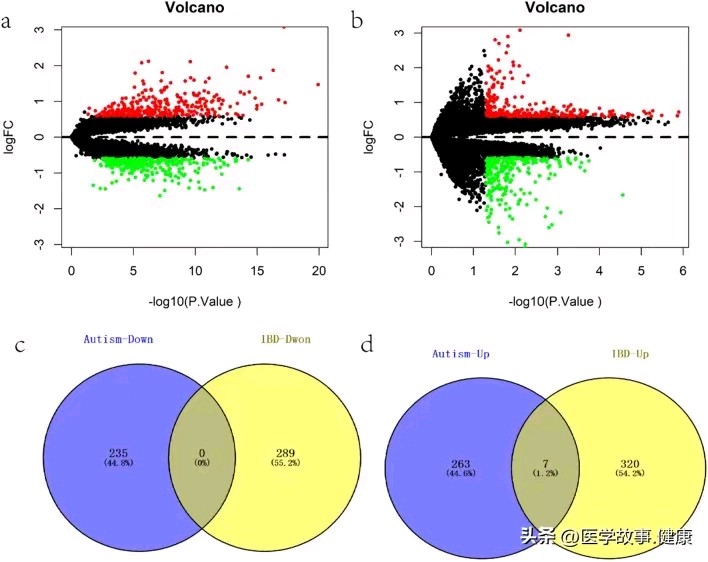
Identification of common differential genes. a Volcano map of DEGs in IBD, green indicates down-regulated DEGs, and red indicates up-regulated DEGs. b Volcano map of DEGs in ASD, green indicates down-regulated DEGs, and red indicates up-regulated DEGs. c, d Venn diagram identifies co-upregulated and co-downregulated DEGs
一、引言
自闭症谱系障碍(ASD)和炎症性肠病(IBD)是两类对患者生活质量有着重大影响的疾病。ASD 涉及社交互动、语言和行为等多方面的异常发育,给患者家庭及社会带来沉重负担,且诊断难度较大。而 IBD 包含溃疡性结肠炎和克罗恩病等类型,长期困扰患者,影响肠道正常功能及整体健康状态。近年来,越来越多的研究提示二者之间存在关联,这促使科学界深入探究其共病的内在分子机制,期望能从根源上理解二者的相互关系,为改善诊断和开发新的治疗策略奠定基础。
二、背景
(一)自闭症谱系障碍概述
ASD 是一类具有高度异质性的神经发育障碍,其症状表现多样,涵盖社交障碍、重复刻板行为、兴趣狭窄以及语言发育迟缓等方面。其发病机制复杂,涉及遗传、环境及二者相互作用等诸多因素。目前,虽然已经发现了众多与 ASD 相关的基因,但仍难以完全解释其发病机理,并且在临床诊断上,也缺乏特异性的生物标志物,多依赖于行为观察等综合评估手段。
(二)炎症性肠病概述
IBD 主要是肠道的慢性非特异性炎症疾病,发病机制与肠道微生物群落失衡、肠道黏膜免疫异常、遗传易感性等因素密切相关。患者常出现腹痛、腹泻、便血等肠道症状,且病情容易反复,严重影响患者的生活质量,长期患病还可能引发一系列肠道外的并发症,给临床治疗带来很大挑战。
自闭症谱系障碍与炎症性肠病共病的分子机制研究进展
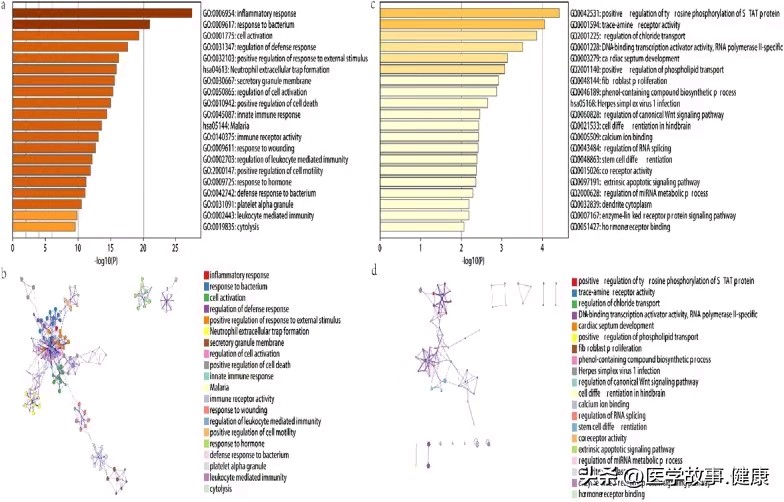
Enrichment analysis. GO and KEGG enrichment analysis of DEGs based on the Metascape database. A cluster network of enrichment pathways; nodes that share the same cluster are usually close to each other. a, b represent IBD, and c, d represent ASD
(三)二者关联的前期研究
既往研究已经显示出 ASD 和 IBD 之间存在潜在相关性,例如一些流行病学调查发现二者在部分人群中的共患情况高于预期,部分 ASD 患者存在肠道通透性异常等胃肠道问题,而 IBD 患者也可能表现出一些类似神经精神方面的异常表现,但对于二者之间具体是如何相互影响、存在哪些共同的病理生理基础等问题仍不清楚,亟待进一步深入探究。
三、研究方法
(一)数据获取
从 Gene Expression Omnibus(GEO)数据库中获取了 GSE3365、GSE18123 和 GSE150115 微阵列数据集。这些数据集包含了大量与疾病相关的基因表达信息,为后续分析提供了基础数据来源。
(二)差异表达基因评估
运用 Limma 软件对 ASD 和 IBD 之间的差异表达基因进行评估,通过比较疾病组与正常对照组的基因表达水平,筛选出在两种疾病中表达有显著差异的基因,以此来初步锁定可能与疾病发生发展密切相关的基因集合。
(三)功能注释分析
进行 Gene Ontology(GO)和 Kyoto Encyclopedia of Genes and Genomes(KEGG)功能注释分析。GO 分析可以从生物过程、细胞组分和分子功能三个层面揭示差异表达基因所参与的具体功能活动;KEGG 分析则侧重于确定这些基因富集的信号通路,有助于了解疾病相关的代谢、信号传导等关键生物学过程。
自闭症谱系障碍与炎症性肠病共病的分子机制研究进展
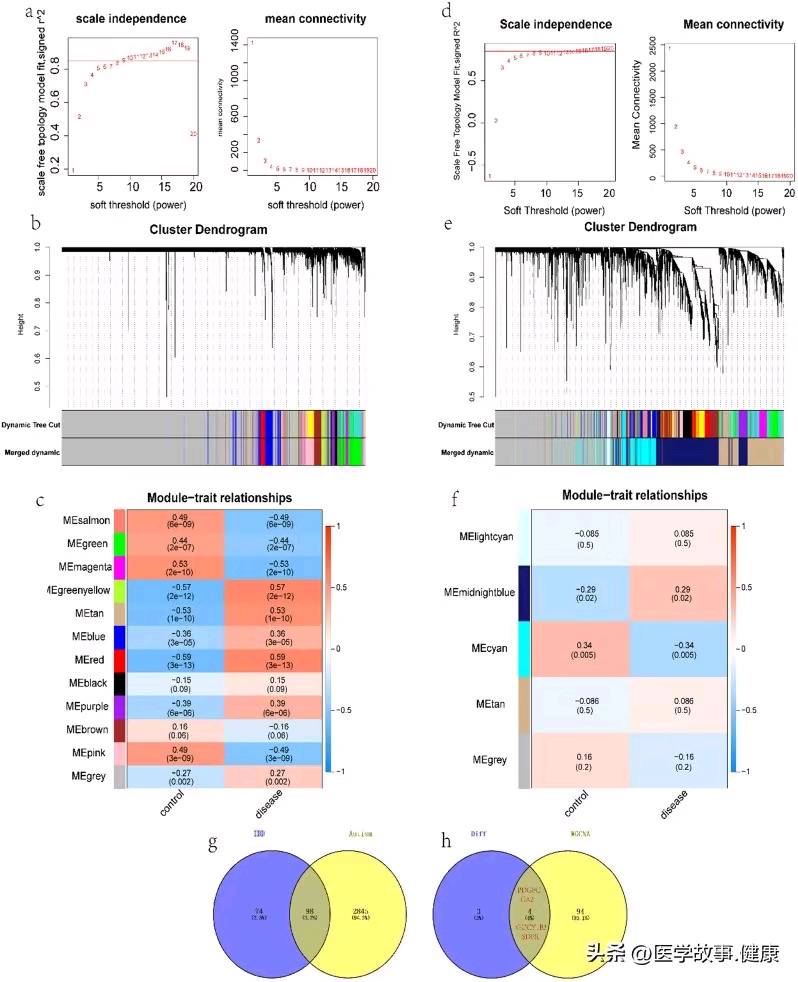
WGCNA. a Scaleless index and average connectivity of individual soft thresholds for IBD. b Dendrogram of IBD gene clustering, with different colours representing different modules. c Heatmap of the correlation between module characteristic genes and IBD; blue indicates negative correlation, and red indicates positive correlation. d Scaleless index and average connectivity of each soft threshold for ASD. e Dendrogram of gene clustering of ASD, with different colours representing different modules. f Heatmap of the correlation between module characteristic genes and ASD; blue indicates negative correlation, and red indicates positive correlation. g, h Venn diagrams identify module intersection genes and hub genes
(四)加权基因共表达网络分析(WGCNA)
通过 WGCNA 构建基因共表达网络,将具有相似表达模式的基因聚类到不同模块中,进而分析各模块与疾病表型之间的关联,从中识别出与 ASD 和 IBD 均相关的共同基因模块,并进一步确定关键的 hub 基因,这些 hub 基因往往在调控网络中处于核心地位,对疾病的发生发展可能起着关键作用。
(五)相关性分析
针对 hub 基因与自噬、铁死亡和免疫等重要生物学过程进行相关性分析,以探究这些 hub 基因在疾病相关的关键细胞生理活动中的作用以及与疾病发生发展的联系。
(六)转录调控分析
开展转录调控分析,如通过 motif-TF 注释分析等方法,了解调控 hub 基因表达的转录因子等相关因素,进一步揭示基因表达调控的上游机制,从更深入的层面解析疾病相关基因表达变化的原因。
自闭症谱系障碍与炎症性肠病共病的分子机制研究进展
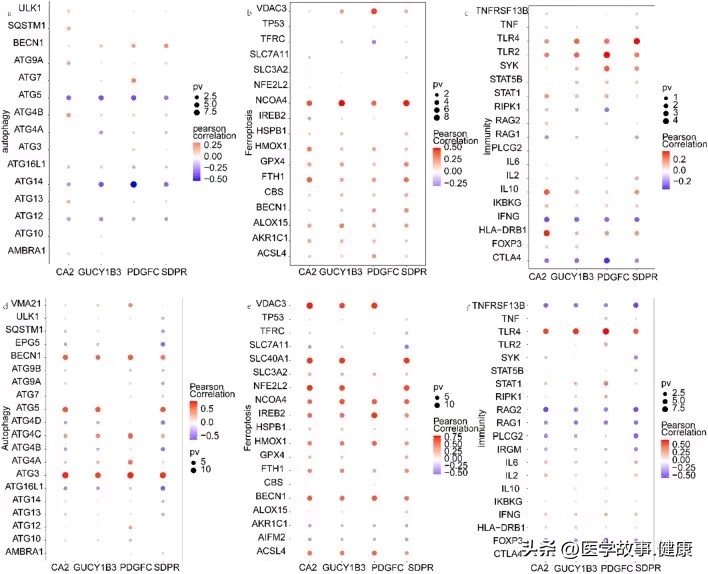
Relationship of hub genes to other genes. a–c Correlation of hub genes in IBD with autophagy, ferroptosis, and immune factors. d–f Correlation of hub genes in ASD with autophagy, ferroptosis, and immune factors
(七)单细胞测序分析
利用单细胞测序技术分析不同细胞类型中基因的表达情况,有助于更精细地了解疾病状态下细胞层面的异质性以及特定细胞类型中关键基因的表达特征,为解析疾病机制提供细胞水平的依据。
(八)潜在治疗药物预测
借助 Connectivity Map(CMap)数据库,基于疾病相关基因表达谱等信息,预测可能对 ASD 和 IBD 共病有效的潜在治疗药物,为后续的药物研发和治疗方案探索提供参考方向。
四、研究结果
(一)差异表达基因的确定
总共鉴定出与 ASD 相关的 505 个差异表达基因以及与 IBD 相关的 616 个差异表达基因,并且在这两组基因中发现有 7 个基因是重叠的,这些重叠基因提示了二者在基因表达层面可能存在的共性基础。
(二)功能富集通路
通过 GO 和 KEGG 分析,发现了多个在两种疾病中均富集的生物学通路,这些通路涉及免疫调节、细胞代谢、信号传导等多个方面,表明在 ASD 和 IBD 的发病过程中,可能存在一些共同的生物学过程参与其中,比如某些免疫相关通路的异常激活或代谢紊乱可能同时影响了神经系统发育和肠道的正常生理功能。
(三)关键基因的筛选
借助 WGCNA 分析确定了总共 98 个与 ASD 和 IBD 相关的共同基因,再与上述 7 个重叠的差异表达基因取交集后,得到了 4 个关键的 hub 基因,分别是 PDGFC、CA2、GUCY1B3 和 SDPR。这些 hub 基因很可能在两种疾病的共病机制中扮演着核心角色,其功能异常可能是引发疾病相关症状以及二者关联的重要因素。
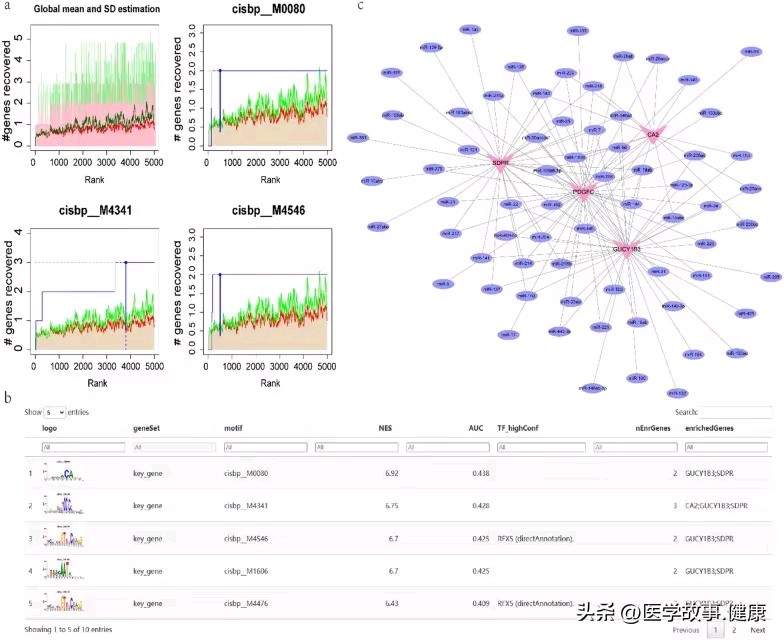
自闭症谱系障碍与炎症性肠病共病的分子机制研究进展
Motif transcriptional regulation analysis. a The three motifs with the highest AUC values. The red line is the average of the recovery curve of each motif, the green line is the mean + standard deviation, and the blue line is the recovery curve of the current motif. The maximum distance point (mean + sd) between the current motif and the green curve is the maximum enrichment level selected. b Demonstration of the highest motif enrichment of AUC, including NES (standardized enrichment score for motifs in gene sets), AUC (area under the curve), and TF_highConf (transcription factors annotated to motifs). c miRNA networks of hub genes, pink for mRNA and purple for miRNA
(四)与重要生物学过程的关联
研究发现这 4 个 hub 基因与自噬、铁死亡或免疫因子等密切相关,自噬、铁死亡过程的失调在多种疾病的发生发展中都起着重要作用,而免疫异常更是 ASD 和 IBD 发病机制中的关键环节,进一步说明了这些 hub 基因可能通过影响这些重要的细胞生理过程,在两种疾病的共病中发挥作用。
(五)转录调控因素
motif-TF 注释分析显示 cisbp__M0080 是最为相关的 motif,这为后续深入研究 hub 基因的转录调控机制提供了重要线索,有助于进一步挖掘影响这些关键基因表达的上游调控网络以及相关的转录因子等因素。
(六)潜在治疗药物
利用 CMap 数据库成功识别出 4 种潜在的治疗药物,为未来开展针对 ASD 和 IBD 共病的药物治疗研究提供了新的方向,有望通过进一步的药物研发和临床试验来验证这些药物的有效性及安全性。
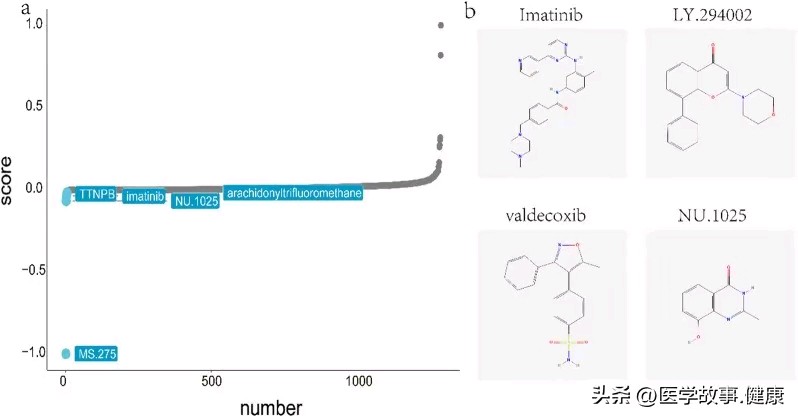
自闭症谱系障碍与炎症性肠病共病的分子机制研究进展
Prediction of potential therapeutic agents for ASD and IBD. a Potential therapeutics predicted by the connectivity map database. b Molecular structure diagram of imatinib, LY.294002, valdecoxib and NU.1025
五、共病机制探讨
(一)免疫调节异常
免疫失衡的共性表现
在 ASD 和 IBD 中都存在免疫调节的异常情况。在 IBD 中,肠道黏膜免疫系统过度激活,大量免疫细胞浸润肠道组织,释放如肿瘤坏死因子 - α(TNF - α)、白细胞介素(IL)系列等炎症因子,破坏肠道黏膜屏障,引发肠道炎症。而在 ASD 方面,也有研究发现患者体内存在免疫细胞功能异常、炎症因子水平改变以及血脑屏障通透性增加等现象,免疫系统的异常可能影响神经发育过程,导致神经行为异常。这种共同的免疫失衡状态可能是二者共病的重要连接点,免疫细胞和炎症因子可能通过血液循环等途径在全身产生影响,既作用于肠道又影响神经系统。
免疫相关基因及通路的作用
上述研究中发现的共同富集的免疫相关通路以及与免疫相关的 hub 基因,如可能参与免疫细胞的分化、迁移、激活等过程的调控,一旦这些基因表达异常或者相关通路失调,就会打破免疫稳态,同时在肠道和神经系统引发病变,促使 ASD 和 IBD 的发生及相互影响。
(二)肠道 - 脑轴的作用
微生物群落与神经 - 肠道双向交流
肠道微生物群落对肠道和大脑之间的双向交流起着关键作用,被称为肠道 - 脑轴。在 IBD 患者中,肠道微生物群落结构发生明显改变,多样性降低,有益菌减少,有害菌增多,这种菌群失调会影响肠道黏膜免疫、肠道屏障功能以及代谢产物的生成等。而这些变化可能通过神经内分泌、免疫和代谢等途径影响大脑的功能和发育,例如某些微生物代谢产物可以穿过血脑屏障,影响神经递质的代谢、神经细胞的活性等。对于 ASD 患者,同样存在肠道微生物群落异常的情况,并且肠道问题如通透性增加等也较为常见,肠道微生物通过肠道 - 脑轴与大脑之间的异常交互作用,可能是导致 ASD 和 IBD 共病的潜在机制之一。
共同的信号通路介导
一些在肠道 - 脑轴交流中起关键作用的信号通路,如迷走神经介导的神经传导通路、神经内分泌相关通路等,可能在 ASD 和 IBD 中都出现了功能异常。这些通路的异常会干扰肠道与大脑之间正常的信息传递和相互调节,使得肠道的炎症状态和大脑的神经发育异常相互影响,进而促使两种疾病共同发生发展。
(三)遗传因素的潜在联系
共享的遗传易感性
虽然 ASD 和 IBD 各自有着复杂的遗传背景,但部分研究提示二者可能存在共享的遗传易感性。某些基因的突变或多态性可能既影响神经系统的正常发育,增加 ASD 的发病风险,同时又对肠道黏膜免疫、肠道屏障等功能相关基因产生影响,提高了 IBD 的患病几率。例如,一些参与细胞间信号传递、免疫调节等功能的基因,如果发生异常,可能在不同的组织器官中引发相应的病理改变,导致两种疾病的共病情况出现。
基因调控网络的交叉影响
从基因调控层面来看,本研究中发现的 hub 基因以及相关的转录调控机制,反映出在基因表达调控网络中存在交叉影响的区域。这些关键基因的调控异常可能涉及多个生物学过程,在不同的组织环境(如肠道组织和神经组织)中产生连锁反应,最终表现为 ASD 和 IBD 的共病现象。
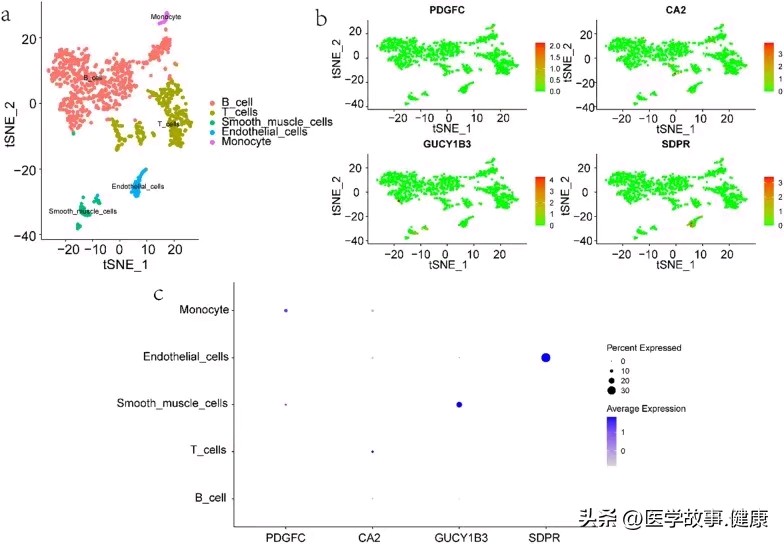
自闭症谱系障碍与炎症性肠病共病的分子机制研究进展
Expression profiles of hub genes in single cells. a Cellular subtypes of ulcerative colitis. b, c Scatter plots and bubble plot of the expression of the 4 hub genes
六、意义与展望
(一)对疾病诊断的意义
明确 ASD 和 IBD 共病的分子机制有助于开发更具特异性和敏感性的诊断标志物。目前,两种疾病的诊断主要依赖临床症状和传统的检查手段,缺乏精准的早期诊断方法。通过深入了解共病机制,有望找到能够同时反映两种疾病状态的生物标志物,实现早期诊断,尽早干预治疗,改善患者预后。
(二)对治疗策略的启发
靶向治疗
基于发现的共同关键基因和相关的生物学通路,可以针对性地开发靶向治疗药物或疗法。例如,设计针对 hub 基因及其上下游调控分子的小分子药物、生物制剂等,通过精准调节这些关键靶点的功能,来同时改善 ASD 和 IBD 的症状,提高治疗效果,减少单一疾病治疗过程中的局限性以及药物副作用等问题。
综合治疗方案优化
了解共病机制后,临床医生可以制定更加综合、个体化的治疗方案,不仅仅关注单一疾病的治疗,而是从整体上考虑如何调节肠道和神经系统的功能,平衡免疫状态等。比如,在治疗 ASD 患者时,除了进行行为干预、神经康复治疗等常规措施外,还可以结合肠道微生态调节等手段来改善肠道炎症和菌群失调情况,或许能更好地缓解患者的整体症状。
(三)研究的局限性与未来方向
研究的局限性
目前的研究虽然取得了一定成果,但仍存在局限性。例如,所使用的生物信息学分析方法依赖于现有的数据库和数据集,数据的质量、样本量以及样本的多样性等因素可能会影响结果的准确性和全面性。而且,大多数分析是基于基因表达层面,对于基因的表观遗传修饰、蛋白质相互作用等更深层次的调控机制还需要进一步探究。另外,预测出的潜在治疗药物还需要经过严格的体内外实验以及临床试验来验证其真正的疗效和安全性。
未来研究方向
未来需要进一步扩大样本量,开展多中心、多地区的联合研究,收集更全面、高质量的数据进行分析。同时,要深入探究基因表达调控之外的其他分子机制,如表观遗传修饰在共病中的作用、肠道微生物群落与宿主基因之间的相互作用机制等。此外,对于潜在治疗药物的研发要加快步伐,积极开展临床试验,以期早日为 ASD 和 IBD 共病患者提供有效的治疗方案。
综上所述,自闭症谱系障碍与炎症性肠病共病机制的研究虽然仍处于不断探索阶段,但目前已经取得的成果为后续深入理解二者关系以及开发诊断和治疗手段提供了重要的基础,未来通过持续的研究有望在这一领域取得更大突破,造福广大患者。