
成 iNature 2025年01月24日 09:19 浙江
iNature
肝脏是胃癌远端转移的主要靶器官。肝脏前转移微环境(PMN)在原发肿瘤与肝脏之间的关键通讯中起着重要作用,从而在肝转移中发挥着至关重要的作用。揭示胃癌中驱动PMN形成的分子机制,有助于开发防治肝转移的策略。
2025年1月15日,浙江大学谢珊珊,周天华和杨月红共同通讯在Cancer Research(IF=12.5)在线发表题为“Ephrin A1 Stimulates CCL2 Secretion to Facilitate Premetastatic Niche Formation and Promote Gastric Cancer Liver Metastasis”的研究论文。该研究发现了ephrin A1(EFNA1)信号通路在PMN发展的作用。
胃癌细胞中过表达EFNA1显著增加了C–C基序趋化因子配体2(CCL2)的分泌,这一过程通过Hippo–YAP通路介导。分泌的CCL2通过WNT/β-连环蛋白通路激活肝星状细胞(HStC)。抑制CCL2显著抑制了HStC的激活,并减少了EFNA1信号在胃癌细胞中诱导的肝转移。此外,高表达CCL2与癌症患者的生存期较差相关。总的来说,这些发现揭示了EFNA1信号通路通过上调CCL2,激活HStC,促使肝脏PMN的建立,从而支持肝转移的发生。

胃癌(GC)对全球健康构成了重大挑战,在癌症发病率中排名第五,癌症相关死亡率中排名第四。其高度倾向于肝转移,显著恶化了患者预后,肝转移影响了近48%的转移性胃癌病例,并导致仅有4%的5年生存率。因此,深入研究胃癌肝转移的机制对于提高患者预后至关重要。
肿瘤转移是一个多步骤过程,首先通过建立前转移微环境(PMN),促进原发肿瘤细胞与靶器官之间的远程通讯。肝脏PMN由多种细胞组成,包括肝星状细胞(HStCs)、库普弗细胞、肝窦内皮细胞、免疫细胞和肝细胞,共同参与其形成。原发肿瘤通过分泌细胞外囊泡(EVs)和可溶性蛋白质来启动PMN的形成,这对扩散肿瘤细胞的着床和存活至关重要。与已知的细胞外囊泡的作用不同,肿瘤分泌的可溶性因子对胃癌中肝脏PMN形成的影响尚未得到充分探索和理解。
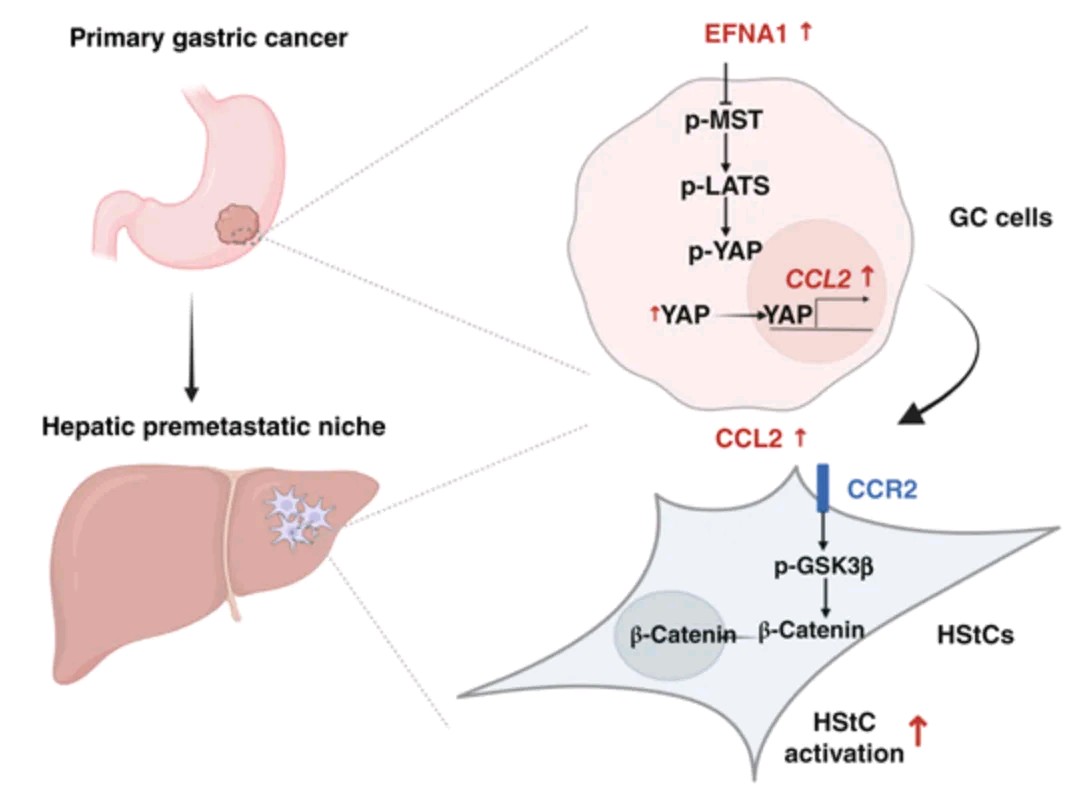
模式机理图(图片源自Cancer Research )
Ephrin家族是Eph受体酪氨酸激酶的配体,其中Ephrin A1(EFNA1)是第一个被TNF-α在人体脐静脉内皮细胞(HUVECs)中刺激的配体。EFNA1在多种实体瘤中表达过高,包括胃癌,并与转移及不良临床预后相关。尽管作者之前的研究已将lncRNA GMAN与调控EFNA1翻译和胃癌转移相关联,但EFNA1在胃癌转移中的具体作用机制仍未得到充分研究。
在本研究中,作者揭示了一种分子机制,EFNA1通过激活YAP促进CCL2表达,进而通过WNT/β-连环蛋白信号通路激活HStCs。这一过程促进了肝脏PMN的形成,从而推动了胃癌肝转移。重要的是,作者发现CCL2表达水平与患者预后之间存在显著关联。总的来说,作者的研究揭示了一种新的机制,EFNA1/CCL2通过促进HStCs激活和肝脏PMN形成,促进胃癌肝转移。
原文链接:
https://doi.org/10.1158/0008-5472.CAN-24-1254