
原创 GanDanXiangZhao 肝胆相照平台
在临床诊疗中发现,部分失代偿期肝硬化患者通过积极的病因及对症支持治疗,可以回到类似代偿期肝硬化的临床表现,出现“再代偿(recompensation)”现象。近年来,关于肝硬化再代偿具体可行的定义及患者的临床特征引发国内外学者的不断探索。
首都医科大学附属北京地坛医院谢雯教授分享肝硬化失代偿期患者再代偿标准探讨,肝胆相照平台特将精华整理成文,以飨读者。
一、失代偿期乙肝肝硬化再代偿:概念提出
2021年,Rajiv Jalan教授提出[1]失代偿是肝硬化临床病程中的一个关键点。在失代偿性肝硬化中,死亡风险由失代偿事件的类型和数量决定。当失代偿仅表现为静脉曲张出血时,定义为3期,5年死亡率为20%;当第一次发生出血以外的失代偿事件时,则划分为4期,5年死亡率为30%;当同时出现两个及以上的失代偿事件时,则进入第5期,5年死亡率为88%。
2019版的慢性乙型肝炎防治指南[2]中,最早提出了肝硬化“再代偿”的概念。随着抗病毒药物的进步,许多失代偿期肝硬化患者经过治疗可以逆转为代偿期肝硬化。表现为肝细胞功能改善,如白蛋白水平较前升高,PT较前缩短,不再出现腹水、肝性脑病等严重并发症,不需要肝移植也可长期存活。这些现象被称为肝硬化再代偿期(re-compensation),但目前尚无准确定义和统一的诊断标准。
二、失代偿期乙肝肝硬化再代偿:现状及难点
目前失代偿期乙肝肝硬化的再代偿研究的难点为“再代偿”的评价指标。
既往肝硬化的评价指标多为病理活检,但是肝脏穿刺活检为有创操作,临床应用受限。影像学评价主要为肝脏硬度(LS)值,包括瞬时弹性成像(TE)、脉冲辐射力成像(ARFI)、2D-剪切波弹性成像(2D-SWE)、磁共振弹性成像(MRE)。
实验室指标和模型包括:Child-Pugh评分(肝性脑病、腹水、血清胆红素、血清白蛋白浓度及凝血酶原时间)、MELD评分(肌酐、胆红素、INR)、终末期肝病模型动态评分(AMELD)、MELD联合血清钠(肌酐、胆红素、INR、钠)。图1所示为目前基于实验室指标评分系统。
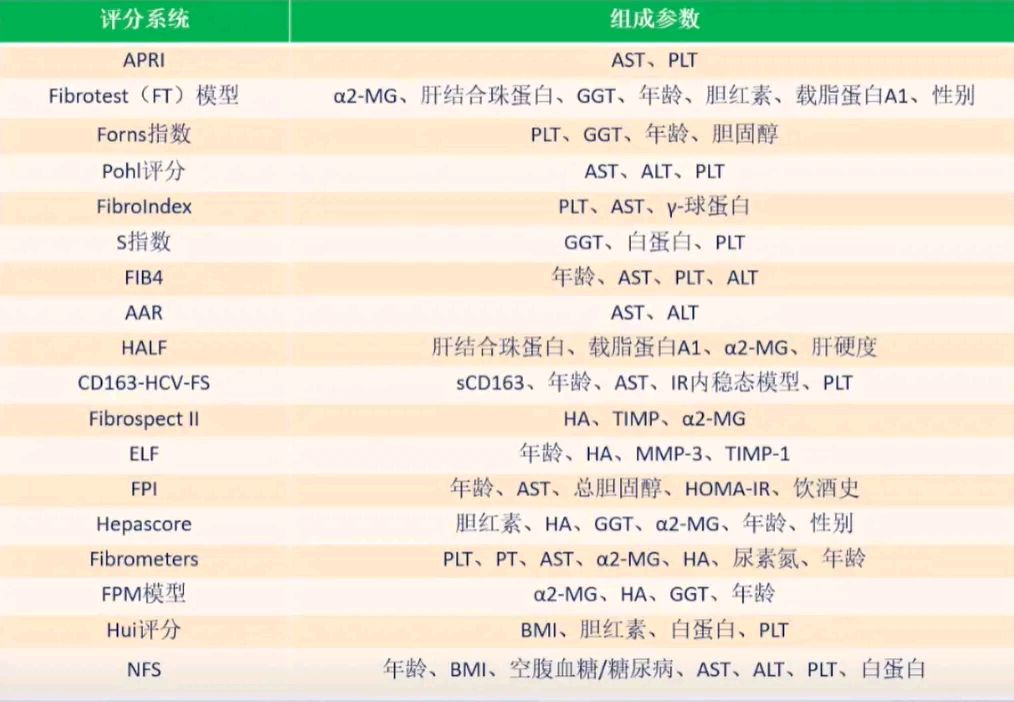
图1. 基于实验室指标的评分系统
2012年,Singal等[3]研究提出Child-Pugh评分可用于“再代偿”的评价。抗病毒治疗1年后,基线Child-Pugh评分≥7分的失代偿期乙肝肝硬化患者,评分下降≥2分比例达49%~72%。2015年,韩国研究提出在进行肝硬化“再代偿”研究时,需要对肝功能基础状态进行分层分析[4]。
三、失代偿期乙肝肝硬化再代偿:探索性临床研究
2022年BavenoII共识[5]首次对肝硬化再代偿进行明确定义:
1. 再代偿的概念是去除肝硬化病因后,至少有部分结构和功能改善(A1);
2. 临床上“再代偿”的定义基于专家共识,需要满足以下所有标准(C2):
1)去除/抑制/治愈肝硬化的主要病因(如,HCV清除、HBV持续抑制、酒精性肝硬化持续戒酒);
2)腹水(停用利尿剂)、肝性脑病(停用乳果糖/利福昔明)消退,且无静脉曲张出血至少12个月;
3)肝功能检查[白蛋白、国际标准化比值(INR)、胆红素]稳定改善。
3. 若腹水消退(使用利尿或TIPS术后),和/或不再发生静脉曲张再出血[使用非选择性β受体阻滞药(NSBB)联合EVL或TIPS术后],但没有去除/抑制/治愈主要病因且无肝脏合成功能改善,不是再代偿的证据(B1);
4. NSBB用药:即使发生再代偿,只要门静脉高压仍然存在,就不应停用NSBB(B1)。
然而,上述再代偿定义并未给出肝功能稳定改善的临界值,无法直接应用于临床判断。
为回答这一重要临床问题,谢雯教授团队对北京市科委重大专项支持的一项前瞻性队列研究数据进行深入分析。对Baveno VII共识提出的肝硬化再代偿定义在乙肝肝硬化失代偿患者中进行了验证,并首次提出了该类患者接受恩替卡韦治疗后实现再代偿所需的肝功能稳定改善标准。
研究论文“Validation of Baveno VII criteria for recompensation in entecavir-treated individuals with hepatitis B-related decompensated cirrhosis”于2022年11月发表在Journal of Hepatology杂志[6]。
该研究由京津冀10家医疗机构参与,历时5年,共入组331名接受恩替卡韦治疗的乙肝肝硬化患者。排除了11例24周内诊断为肝细胞癌的患者后,共分析患者320例。283例患者完成了120周随访。
基线特征及治疗效果
患者平均年龄为52岁±11岁,其中61.9%(198/320)为男性。平均HBV DNA水平为5.25±1.83 log10 IU/ml。ALT的中位数水平为53.0(IQR 35.1–100.9)IU/L,其中66.9%(214/320)的患者ALT升高(>40 IU/L)。Child-Pugh和MELD的平均得分分别为8.33±1.90和13.37±4.44。
治疗48周及120周后,患者的肝功能检查等变化如图2所示。在第120周,所有患者的平均HBV DNA水平从基线显著下降(从5.25±1.83下降到1.19±0.89log10 IU/ml,p<0.001)。
在完成研究的283名患者中,92.2%的HBV DNA水平低于检测下限。ALB水平较基线显著升高,ALT和AST水平较基线显著下降。Child-Pugh评分从8.33±1.90降低到5.77±1.37(p<0.001),MELD评分从13.37±4.44降至10.45±4.58(p<0.001)。
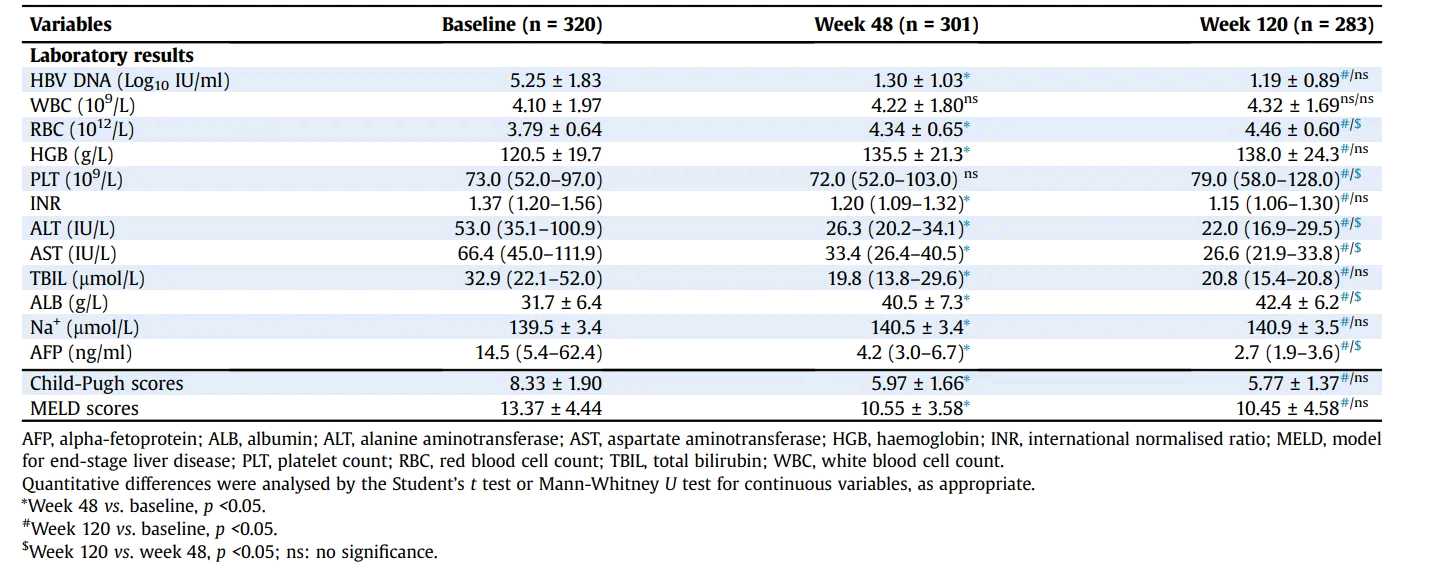
图2. 治疗48周及120周后,患者的肝功能检查等变化
120周有或没有“再代偿”患者的基线特征和治疗效果
研究将患者分为失代偿事件临床缓解组(n=171)和未缓解组(n=112),以比较其基线特征和治疗效果。这两组患者在基线时的Child-Pugh和MELD评分没有差异(8.39±1.90 vs. 8.26±1.86, p=0.580; 13.67±4.49 vs. 12.88±4.15, p=0.143)。但是与失代偿事件未临床缓解组相比,失代偿事件临床缓解组患者治疗24周至120周的Child-Pugh评分和MELD评分改善更明显(图3)。
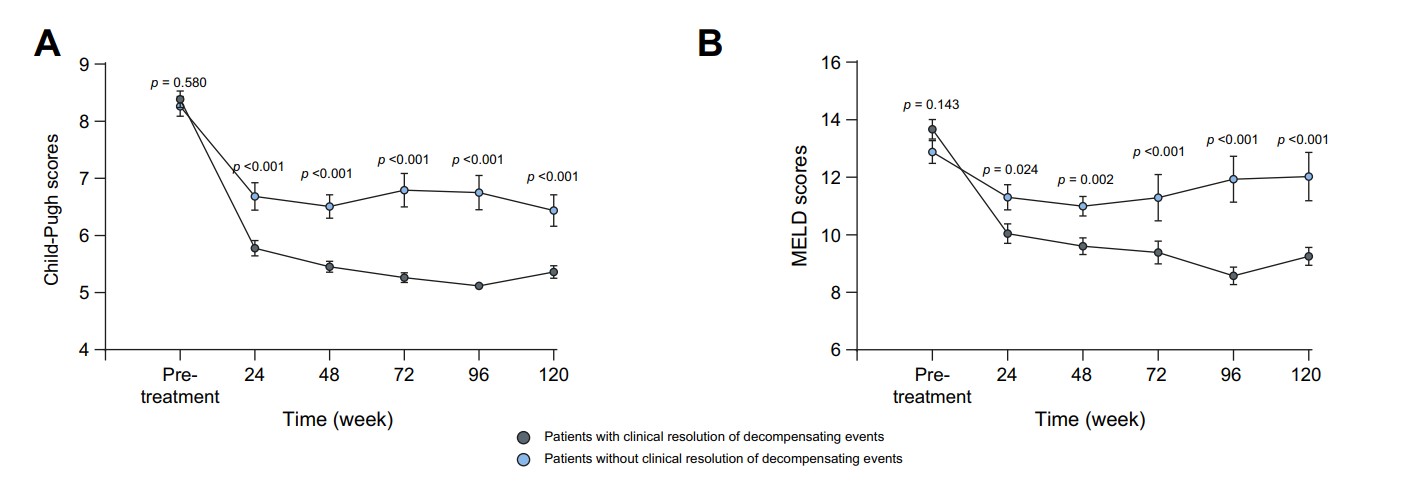
图3.失代偿事件临床缓解组/未缓解组患者Child-Pugh评分和MELD评分变化
虽然两组患者在120周治疗期间肝功能检查均有所改善,但失代偿事件临床缓解组患者肝功能检查稳定改善的比例显著高于未缓解组,如图4所示。
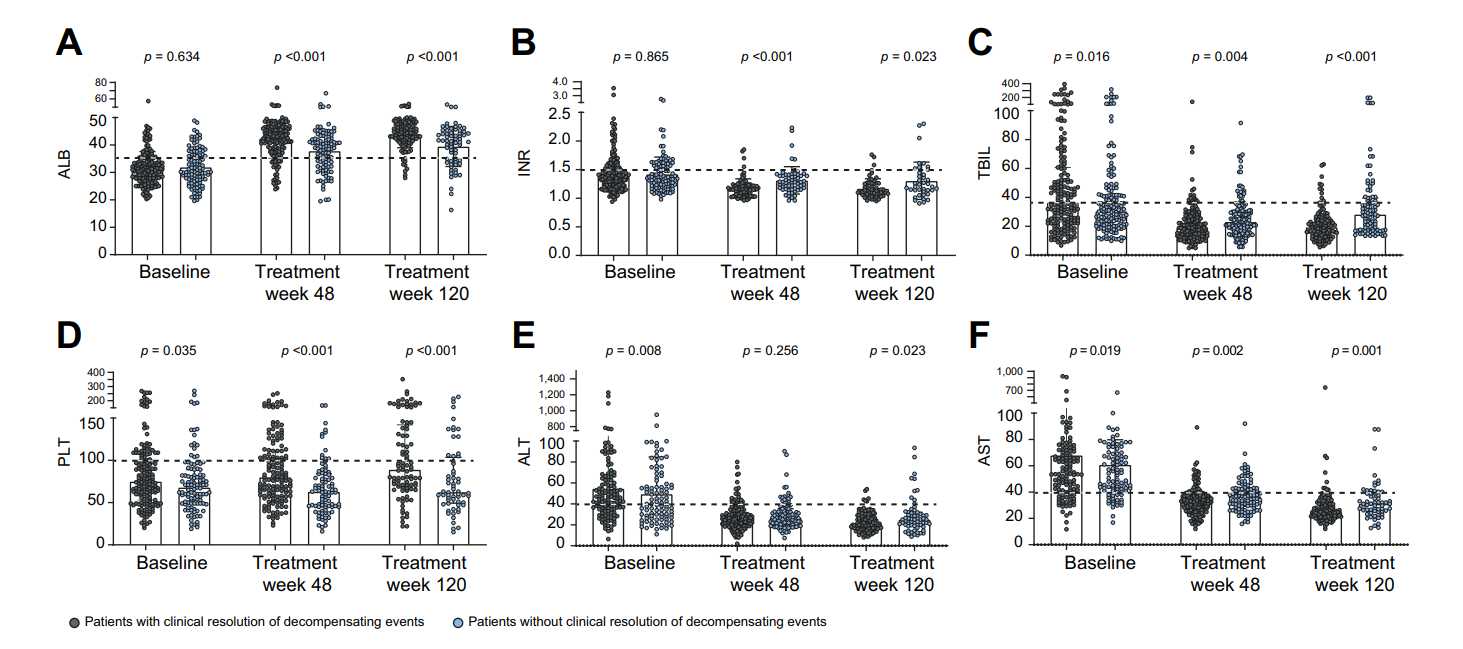
图4. 失代偿事件临床缓解组/未缓解组患者肝功能变化
图5所示桑基图表示从基线到第120周的Child-Pugh评分的变化。列的颜色代表不同Child-Pugh评分的患者,绿色代表Child-Pugh-A,黄色代表Child-Pugh-B,红色代表Child-Pugh-C。列的长度表示患者的比例。线越粗,涉及的患者数量就越多。
(A)整个队列(n=283)。
(B)失代偿事件临床缓解组的患者(n=171)。
(C)失代偿事件临床未缓解组的患者(n=112)。
结果显示失代偿事件临床缓解组Child-Pugh评分下降的比例高于失代偿事件临床未缓解组,ChildPugh C级肝硬化患者的数量显著减少。
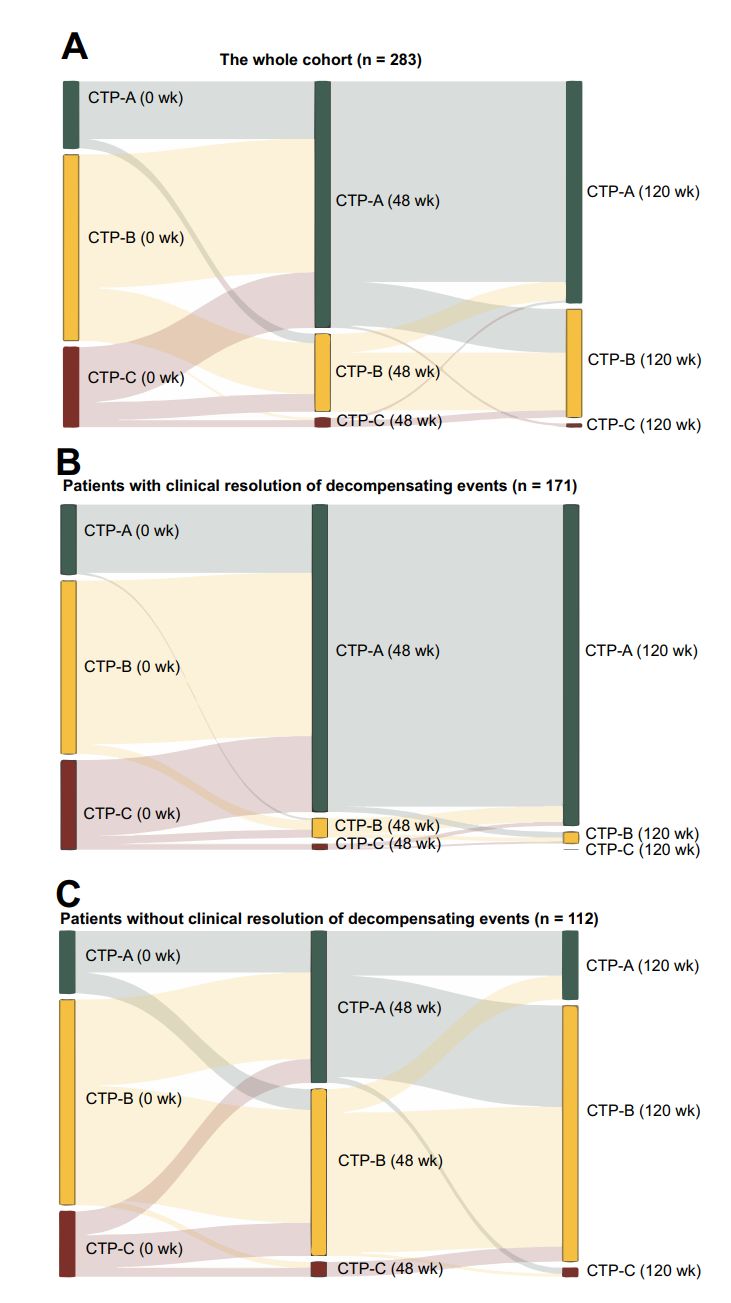
图5. 基线到第120周的Child-Pugh评分变化桑基图
稳定改善肝功能检查的临界值
总体而言,完成120周恩替卡韦治疗的所有283例患者均实现了病毒学抑制。其中171/283(60.4%)患者达到了Baveno VII定义的临床事件再代偿标准,即至少12个月没有出现腹水、肝性脑病以及复发性静脉曲张出血。
在第48周,这171名患者中有130名肝功能指标恢复至Child-Pugh A级肝功能水平(白蛋白>35 g/L,INR<1.50 和总胆红素<34μmol/L)。142名患者MELD评分低于10分。
因此,我们建议使用这些临界值作为肝功能检查稳定改善的标准,即MELD评分<10分和/或肝功能指标恢复至Child-Pugh A级肝功能水平(白蛋白>35 g/L,INR<1.50 和总胆红素<34μmol/L)。
失代偿事件临床缓解相关因素
通过单因素分析,研究揭示了与失代偿事件临床缓解相关的几个基线变量,包括更高的HBV DNA、ALT、AST、Na和AFP(均p<0.05)。多变量分析显示,以下2个基线变量与失代偿事件的临床缓解独立相关:较高的AST(OR:0.996;95%CI 0.993–0.999;p=0.011)和更高的Na(OR:0.890;95%CI 0.823–0.963;p=0.004)(图6)。
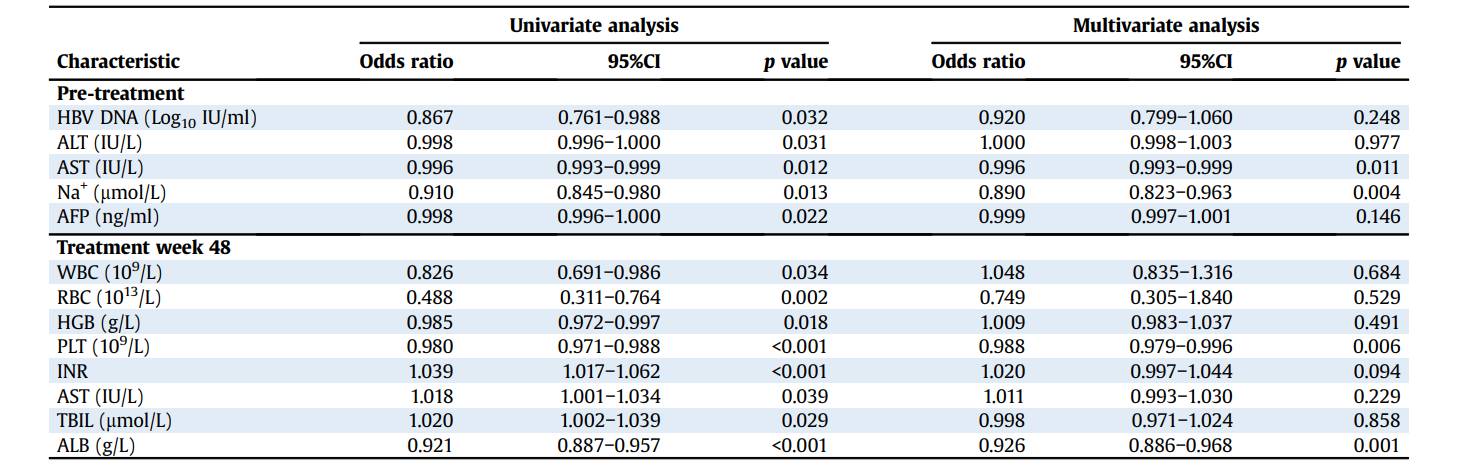
图6. 失代偿事件临床缓解相关因素的单因素及多因素分析
四、总 结
本研究数据被中国慢性乙型肝炎诊治指南2022版引用。这是Baveno VII再代偿定义在HBV相关肝硬化患者中的首次前瞻性验证。
肝功能测试的稳定改善被定义为MELD评分<10分和/或肝功能指标恢复至Child-Pugh A级肝功能水平(白蛋白>35 g/L,INR<1.50和总胆红素<34μmol/L)。治疗中MELD评分可能比基线MELD评分更能预测再代偿的可能性。及时的抗病毒治疗对HBV相关肝硬化患者有效,即使在失代偿期肝硬化的患者中也是如此。
参考文献 上下滑动查看
[1] Jalan R, D'Amico G, Trebicka J, et al. New clinical and pathophysiological perspectives defining the trajectory of cirrhosis[J]. J Hepatol, 2021, 75 Suppl 1: S14-S26.[2] G Wang, F Wang, H Zhuang, et al. 2020, 10(01): 1-25.王贵强,王福生,庄辉,等. 慢性乙型肝炎防治指南(2019年版)[J]. 中国病毒病杂志, 2020, 10(01): 1-25.[3] Singal A K, Fontana R J. Meta-analysis: oral anti-viral agents in adults with decompensated hepatitis B virus cirrhosis[J]. Aliment Pharmacol Ther, 2012, 35(6): 674-689.[4] Jang J W, Choi J Y, Kim Y S, et al. Long-term effect of antiviral therapy on disease course after decompensation in patients with hepatitis B virus-related cirrhosis[J]. Hepatology, 2015, 61(6): 1809-1820.[5] de Franchis R, Bosch J, Garcia-Tsao G, et al. Baveno VII - Renewing consensus in portal hypertension[J]. J Hepatol, 2022, 76(4): 959-974.[6] Wang Q, Zhao H, Deng Y, et al. Validation of Baveno VII criteria for recompensation in entecavir-treated patients with hepatitis B-related decompensated cirrhosis[J]. J Hepatol, 2022, 77(6): 1564-1572.
专家简介

谢雯 教授
主任医师、教授、博士生导师,首都医科大学附属北京地坛医院、国家传染病医学中心(北京)肝病中心主任,北京医学会肝病学分会候任主任委员,中国防痨协会结核病与肝病专业分会副主任委员,中国毒理学会临床毒理学分会副秘书长,中华医学会肝病学分会肝炎学组委员,中华医学会肝病学分会药物性肝病学组委员,担任国家科技奖励评审专家,国家自然科学基金评审专家,《肝脏》《临床肝胆病杂志》等多家杂志编委及多家SCI杂志审稿专家。主持及参与国家自然科学基金5项,主持北京市科委及首都医学发展科研基金重点支持及面上项目8项。重点研究领域在失代偿期肝硬化患者的再代偿研究及脂肪性肝病、药物性肝损伤的临床及基础研究。以第一及通讯(含共同)作者发表SCI文章 21篇(含Journal of Hepatology、Clinical Gastroenterology and Hepatology、Cellular and Molecular Life Sciences等杂志);主编参编专著8本。本文图片源自授课幻灯,整理/肝胆相照 审校/谢雯教授