
医学故事.健康 中华医学会理事 神经外科教授

识别肿瘤高危人群,揭示免疫浸润的遗传决定因素
肿瘤周围有复杂的环境成分,包括血液和淋巴管、成纤维细胞、内皮细胞、免疫细胞、细胞因子、细胞外囊泡(extracellular vesicle)和细胞外基质(extracellular matrix)。这些基质成分与肿瘤细胞共同构成肿瘤微环境(tumor microenvironment,TME)。此外,细胞外物理和化学因素,包括细胞外pH、缺氧、间质液压力(nterstitial fluid pressure)升高和纤维化,与肿瘤进展、转移、免疫抑制和耐药密切相关。TME中的细胞和细胞外成分几乎参与了所有的癌变过程。研究并阐明TME与肿瘤的相互作用机制,有利于肿瘤治疗。
随着人们对肿瘤的认识逐步加深,在理解癌症的发生原因和设计新的抗癌疗法时,目光都已不再只聚焦于癌细胞本身,而是把视角扩展到更全面的概念,即由肿瘤细胞、基质细胞、免疫细胞和细胞外基质共同组成的复杂生态系统,也就是肿瘤微环境(tumor microenvironment,TME)。
肿瘤微环境中的宿主细胞既往被认为是肿瘤发生的旁观者,现在被视为促进恶性种子生长的“肥沃土壤”。在不同类型的癌症、不同的个体之间,肿瘤微环境的细胞组成和功能状态存在显著的异质性,导致了患者肿瘤易感、预后和免疫治疗效果的差异。因此,解析TME的细胞组成并探究其异质性的决定因素,有助于鉴定新的肿瘤分子标志物和潜在药物干预靶点。
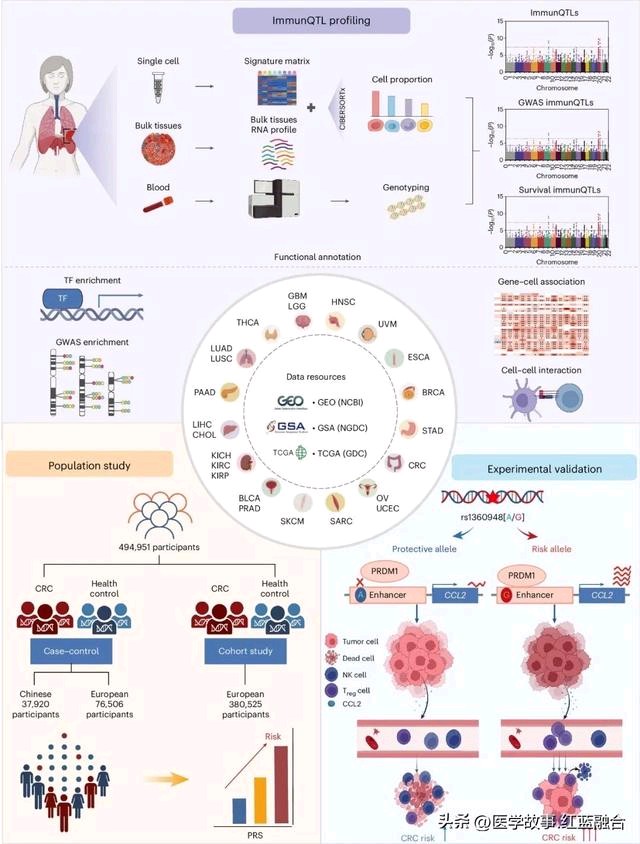
日前,武汉大学公共卫生学院缪小平教授和田剑波教授领衔的研究团队在《自然》子刊Nature Immunology发表论文,采用单细胞RNA测序等前沿技术绘制了肿瘤微环境中免疫细胞遗传调控图谱,并揭示其作用模式及早筛应用价值。

识别肿瘤高危人群,揭示免疫浸润的遗传决定因素
研究作者指出,鉴于肿瘤微环境的细胞组成十分复杂,要分析肿瘤浸润细胞如何受到遗传调控,需要借助高细胞分辨率的技术详尽描述细胞类型,以及利用大规模的样本来系统鉴定影响免疫浸润的遗传决定因素(免疫调控性遗传位点,immunQTLs)。
为此,研究人员首先利用单细胞RNA测序数据构建了细胞特异性表达矩阵,基于机器学习算法量化了肿瘤样本中总共54种细胞的相对含量,囊括23种肿瘤类型,7707例样本。结合样本的全基因组遗传数据,研究人员总共鉴定出3494个immunQTLs。
功能注释揭示,immunQTLs可能通过调控免疫浸润相关基因表达影响TME细胞组成,进而影响肿瘤系列表型并解释肿瘤易感的遗传归因。此外,研究者还揭示immunQTLs的靶基因密切参与机体免疫以及肿瘤相关的多个生物学过程,并与多种免疫药物反应相关,为未来临床药物靶标的筛选提供了数据参考。
研究进一步绘制了中国人群结直肠癌免疫浸润遗传调控图谱。利用团队前期154例结直肠癌的正常组织和肿瘤组织的转录组、基因组等多维度组学数据,并整合单细胞组作为参考数据,研究人员鉴定出568个immunQTLs,这些位点在结直肠癌的易感区域显著富集,并在癌症基因组图谱TCGA中较好验证。
非常有意义的是,研究者整合immunQTLs以及结直肠癌GWAS位点构建的多基因风险评分模型(Polygenetic risk score, PRS)能有效提高结直肠癌风险分层效能和高危人群识别能力。利用团队前期构建的多中心中国人群结直肠癌的病例-对照样本(21874例),发现相比低遗传风险的个体,同样的环境暴露下,携带高遗传风险评分的个体罹患结直肠癌的风险增加1.95倍。
该模型在欧洲和美洲多个独立结直肠癌人群中也得到了很好的验证。研究者进一步将该模型应用在大规模的自然人群队列中,发现该模型对新发结直肠癌同样具备较好的预测效能和高危人群分层能力。在多个独立、大规模、多维度的人群队列样本中,层次递进的验证表明了模型风险预测的稳健性和可靠性,表明免疫浸润相关遗传位点不仅有助于剖析肿瘤免疫调控新机制,还有望应用于肿瘤高危人群识别和早筛方案的制定。
以免疫调控效能最强的遗传变异位点CCL2-rs1360948为例,研究团队展开了多种族、多中心的人群流行病学研究。对76506例欧洲人群和37920例中国人群的分析发现,rs1360948-G显著增加结直肠癌的风险,并缩短患者预后生存期。
进一步实验揭示了机制:该变异能够提高其所在增强子区域与转录因子PRDM1的结合能力,通过染色质三维折叠远程促进目标效应基因CCL2的表达,后者招募更多的调节性T细胞浸润来发挥免疫抑制作用,进而促进肿瘤细胞的免疫逃逸,最终导致结直肠癌风险增加和预后不良。
另外,研究者发现靶向CCL2-CCR2信号轴则能够增强免疫疗法PD-L1抗体的治疗效果。免疫动物模型显示,CCL2-CCR2单抗和PD-L1单抗具备较好的联合抗肿瘤效果,为结直肠癌患者精准防治提供了潜在的联合治疗策略,尤其是发生遗传变异的个体。
识别肿瘤高危人群,揭示免疫浸润的遗传决定因素
研究示意图(图片来源:参考资料[1])
综上,这项研究明确了机体胚系遗传变异在肿瘤微环境异质性中的作用,提供了全面的肿瘤免疫浸润遗传调控图谱,揭示胚系变异可能通过调控免疫反应在肿瘤发生和进程中发挥着关键作用,为解析肿瘤免疫的遗传精细调控提供了新的线索。论文最后介绍,研究作者已建立了一个数据库(CancerlmmunityQTL2)服务于研究界,促进对癌症发病机制中免疫基因组相互作用的理解。
此外,该研究受编辑邀请撰写了题为“Genomic map of cellular composition of the tumor microenvironment”的Research Briefing,进一步概述了研究的关键发现及其在肿瘤免疫领域的意义和价值。
参考资料:
[1] Yimin Cai et al., An atlas of genetic effects on cellular composition of the tumor microenvironment. Nature Immunology (2024) Doi: https://doi.org/10.1038/s41590-024-01945-3