
医学故事.健康红蓝 中华医学会理事 神经外科教授
随着具有大流行潜力病毒的出现,确定它们如何与人类细胞相互作用非常重要。本文的新研究提供了一个工具来预测那些新出现的病毒可能带来的影响。 研究团队使用AlphaFold预测蛋白质三维结构,发现不同氨基酸序列的蛋白质可能具有相似的3D形状和功能。多达25%的未注释病毒蛋白(unannotated viral protein)可能参与免疫逃逸,其中RNA连接酶T样磷酸二酯酶(RNA ligase T-like phosphodiesterase)在感染真核生物的病毒与噬菌体中都广泛存在,表明这是一种广泛保守的免疫逃逸策略。总之,病毒蛋白结构数据分析为确定病毒组中常见的病毒-宿主相互作用机制提供了新机会。
病毒有着强大的感染能力,其中一项秘诀就在于它们能够快速进化,持续产生帮助它们感染宿主的全新蛋白,其中包括一些对于病毒感染与复制至关重要,但功能未知的蛋白。这些大量存在的未知蛋白,也成为了理解病毒的感染机制与进化、进一步开发抗病毒疗法的重要挑战。
病毒蛋白难解,序列差异巨大是一个重要原因。为了弄清某种未知蛋白的功能,科学家们会寻找其中独特的氨基酸序列与功能已知蛋白的氨基酸序列之间的相似性,这种序列相似性有时可以表明蛋白质的功能。然而,病毒进化太快了,这会产生很多缺乏序列同源物的蛋白质。当氨基酸一致性过低,基于序列的相似性检索作用就很有限了。
既然序列无法提供我们想要的答案,我们还能从病毒的其他信息里找到蛋白质功能的线索吗?
一个可能的答案是蛋白质结构。正如不同的积木可以搭成相似的建筑结构,氨基酸序列不同的蛋白质也可能拥有相近的三维结构,以及相似的生物学功能。病毒之间,以及病毒与细胞之间的水平基因转移会产生结构关系,如果可以检测到这些结构关系,就可以提供有关蛋白质功能的信息。
说起蛋白质结构,AlphaFold无疑是绕不开的话题。AlphaFold初次亮相便破解了生物学持续50年的蛋白质折叠问题,能够根据蛋白质的氨基酸序列预测蛋白质三维结构。2年前,其成功预测出超过100万个物种的2.14亿个蛋白质结构,将预测的蛋白质结构数量提升了数百倍。就在3个月前,最新的AlphaFold 3能够准确预测所有生命分子结构和相互作用,使我们可以破解各种生物分子复合体结构。
(更多阅读:AlphaFold 3重磅登场!准确预测所有生命分子结构和相互作用,药物研发迎来全新革命)
AlphaFold的功能固然强大,但在AlphaFold数据库中,已预测的蛋白质结构里却没有这些病毒蛋白的身影。
为了弥补这一缺失,并开发能够系统性预测病毒蛋白功能的新方法,CRISPR先驱、2020年诺贝尔化学奖得主Jennifer Doudna教授带领团队取得了一项新进展。在本周《自然》杂志的最新论文中,研究团队预测出近7万种病毒蛋白的三维结构,并且从中发现了病毒逃避宿主免疫系统的古老机制。Doudna教授表示,这项研究为预测新出现的病毒功能提供了全新工具,并将帮助开发出对抗病毒感染的新策略。

《自然》揭开病毒蛋白面纱!病毒突破免疫防线的新机制
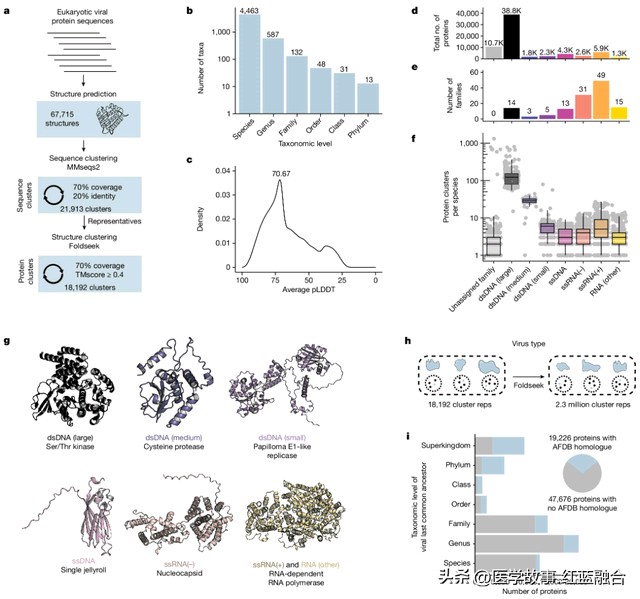
在研究的开端,研究团队首先预测了来自4463感染真核生物的病毒的67715种蛋白质三维结构,并且生成了预测结构数据库。接下来,作者依次根据序列和结构对这些蛋白质进行了两步聚类,形成了5770个多成员聚类和12422个单成员聚类(共18192个)。
《自然》揭开病毒蛋白面纱!病毒突破免疫防线的新机制
感染真核生物病毒的结构蛋白质组(图片来源:参考资料[1])
要进一步揭开这些病毒蛋白与已知蛋白的关联,就需要与已知蛋白质的结构进行对比。为此,研究团队使用了一款名为Foldseek的工具,将最新发现的18192个未知病毒蛋白聚类,依次与来自AlphaFold数据库的230万个已知蛋白聚类进行了比较。
结果,研究发现62%的病毒蛋白仅存在于单一的病毒家族中,并且在AlphaFold数据库中缺乏类似的结构,这些结构表明病毒进化产生了大量当前结构数据库中不存在的新型蛋白。
另一方面,在剩余的38%病毒蛋白中,很多拥有与非病毒蛋白类似的结构,这种匹配程度揭示了人类病原体与其真核宿主之间的相似性。
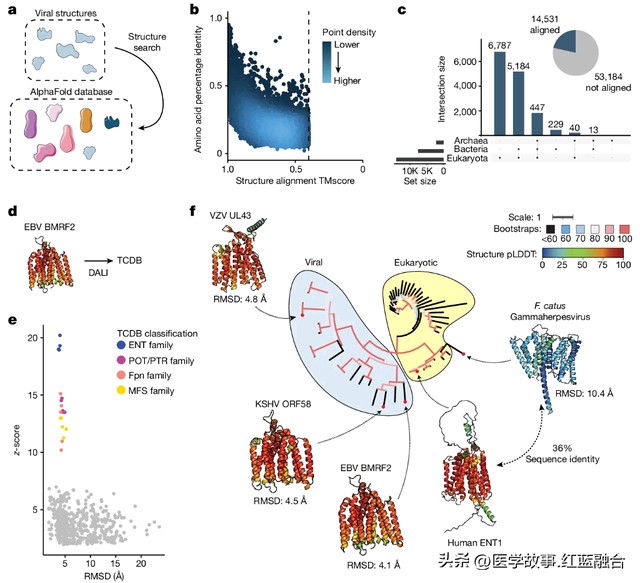
例如,研究对UL43样蛋白这个代表性案例进行了讨论。对比研究发现部分新预测的病毒蛋白结构就属于UL43样蛋白,而UL43样蛋白存在于人类疱疹病毒,包括EB疱疹病毒(Epstein-Barr virus)和水痘-带状疱疹病毒。值得注意的是,UL43样蛋白与人类平衡核苷转运蛋白 ENT4 具有结构相似性,提示它们可能起到转运作用。
《自然》揭开病毒蛋白面纱!病毒突破免疫防线的新机制
病毒与其他生物蛋白的结构相似性揭示了潜在功能(图片来源:参考资料[1])
这些发现说明,病毒和非病毒蛋白之间普遍存在的结构相似性,并且这种相似性可用于预测表征不佳的病毒蛋白的潜在功能。
除了与非病毒蛋白的结构进行比对分析,研究团队还比较了这些新预测病毒蛋白与已知病毒蛋白的结构。结果,多达25%的新预测病毒蛋白具有潜在的功能,尤其是在免疫逃逸中发挥作用的蛋白。
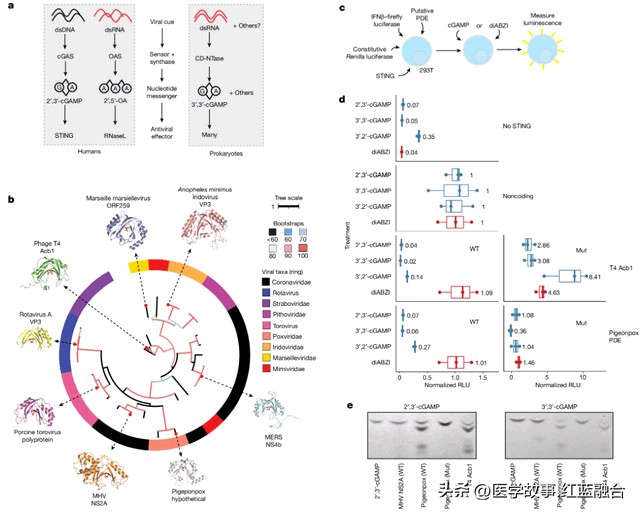
其中,RNA连接酶T样磷酸二酯酶(简称LigT样PDE)在病毒抗免疫中具有保守作用。研究发现几种RNA病毒编码降解2′,5′-寡腺苷酸的PDE,并且它们具有类似于LigT样的折叠。结构检索显示,在感染真核生物的病毒中,存在LigT样PDE的多个分支。
一系列实验表明,LigT样PDE 靶向cGAMP是一种广泛存在于噬菌体和感染真核生物的病毒中的免疫逃逸机制,其似乎在整个进化过程中都得到了保留,并且已经被不同病毒多次适应,用于逃避先天免疫攻击。因此,这些发现或将帮助科学家们进一步理解病毒感染方式,并带来增强抗病毒防御的新策略。
《自然》揭开病毒蛋白面纱!病毒突破免疫防线的新机制
LigT样PDE常用于破坏宿主的免疫攻击(图片来源:参考资料[1])
作者总结道,这项研究呈现了设计广泛有效的抗病毒疗法的新方法,例如上述免疫逃逸机制的发现有望用于开发同时对抗多种病毒的强效抗病毒药物。
参考资料:
[1] Nomburg, J., Doherty, E.E., Price, N. et al. Birth of protein folds and functions in the virome. Nature (2024). https://doi.org/10.1038/s41586-024-07809-y
[2] 3D shapes of viral proteins point to previously unknown roles. Retrieved on Aug 26, 2024 from https://www.eurekalert.org/news-releases/1055749