
医学故事.红蓝融合 中华医学会理事 神经外科教授
缺血性卒中仍然是全球范围内导致死亡和残疾的主要原因。
卒中发生时,缺血状态导致脑梗塞区域严重缺乏葡萄糖和氧气,显著增加了谷氨酸的释放和积累,浓度上升至正常生理水平的10至100倍。这种过量的谷氨酸会通过诱导N-甲基-D-天冬氨酸受体(NMDARs)过度激活引起兴奋性毒性,使得大量钙离子流入神经元以致于超载,导致细胞死亡。因此NMDARs成为卒中治疗的重要靶点。
虽然NMDARs拮抗剂在实验模型中显示出神经保护作用,但在临床上效果不佳甚至诱发患者出现精神问题,暗示阻断NMDARs并不是缺血性卒中治疗的唯一解答。
近日,上海交通大学医学院附属第六人民医院殷善开、时海波和加拿大多伦多大学王路阳合作的最新研究首次揭示,在缺血性脑损伤中,谷氨酸还可以通过增加酸敏感离子通道(ASICs)对酸性环境的敏感度和开放程度,促进其活性,引发兴奋性毒性,而非仅仅通过NMDARs,表明ASICs是之前未被充分考虑的卒中治疗靶点。
他们开发的小分子LK-2能够特异性阻断谷氨酸与ASICs的结合,而避开影响NMDARs。在体内外实验中,LK-2有效减轻由缺血引起的脑损伤,并改善卒中小鼠模型的长期运动功能。
论文于近日发表在顶刊《自然》[1]。

《自然》:发现缺血性卒中脑损伤全新机制,并发现治疗新思路
论文首页截图
酸敏感离子通道(ASICs)在中枢神经系统中广泛表达,对环境pH变化高度敏感,在脑缺血时因局部酸中毒而激活。人们认为,NMDARs和ASICs在卒中发生时具有协同作用,分别被谷氨酸和氢离子激活,加剧神经元死亡。
之前有研究显示,ASICs的活性实际上也能够被谷氨酸增强。为深入解析谷氨酸是否直接与神经元中的ASICs相互作用及其在缺血损伤中的具体作用,研究团队展开了本次探索。
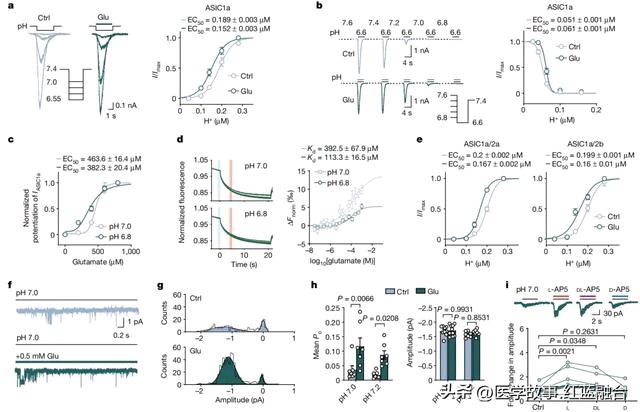
他们在表达人类ASIC1a(ASICs家族中的一员)的CHO细胞中,使用膜片钳技术记录电流情况。结果观察到,谷氨酸能够增强ASIC1a中的电流,使处于关闭状态的ASIC1a更有效地响应酸性环境变化,促进ASIC1a在pH 7.0或7.2的更温和条件下开放,而没有改变其导电率或离子选择性。
《自然》:发现缺血性卒中脑损伤全新机制,并发现治疗新思路
谷氨酸及其结构类似物可以强烈增强ASICs的电流
微量热泳动实验结果证实,谷氨酸可以直接与ASIC1a结合,且在较低的pH值下结合更紧密。此外,几种谷氨酸结构类似的NMDA、AMPA、天冬氨酸,均显示出与谷氨酸类似的效果。
利用正常表达或敲除表达ASIC1a的多种小鼠模型,研究团队发现,谷氨酸和氢离子协同调控着ASICs的活性——谷氨酸的存在,导致即使在轻微酸化条件下,ASIC1a也会通过介导钙超载对神经元造成致命伤害。在pH 7.0左右,谷氨酸和氢离子共同作用于ASICs,促进钙离子通过ASICs流入神经元,引起线粒体功能失调、膜兴奋性和下游信号传导,从而导致神经毒性和神经元死亡。
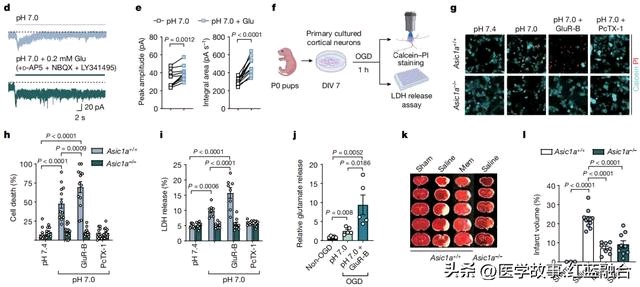
通过比较NMDARs拮抗剂和ASICs敲除对卒中小鼠的脑梗塞体积的影响,可以观察到阻断ASICs在减少缺血性脑损伤方面可以达到与阻断NMDARs相似的保护效果,这表明ASICs在卒中治疗中的地位可能与NMDARs同等重要。
《自然》:发现缺血性卒中脑损伤全新机制,并发现治疗新思路
谷氨酸加剧神经毒性
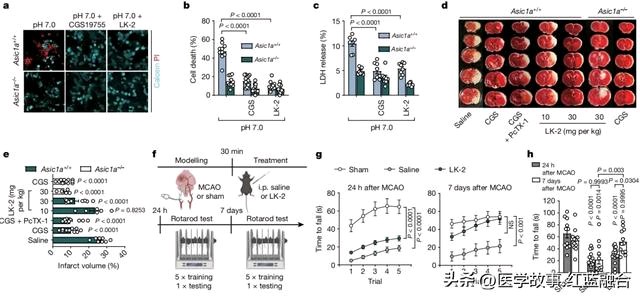
研究团队进一步确定了谷氨酸在ASICs中的结合位点,并发现一种已有的NMDARs拮抗剂(CGS19755)同样可以作为ASICs的强效竞争性拮抗剂。但是,鉴于目前临床上显示阻断NMDARs具有副作用,研究团队基于CGS19755结构进行药物筛选,开发了能够靶向ASICs与谷氨酸结合位点而对NMDARs影响很小的药物化合物LK-2。
在临床前小鼠模型实验中,选择性阻断AISCs的LK-2(腹膜内注射30mg/kg)能有效减轻由缺氧引起的神经元损伤,效果与可以同时阻断ASICs、NMDARs的CGS19755相当,并显著减少缺血性卒中小鼠的脑损伤区域。这暗示谷氨酸通过作用于ASICs而非NMDARs其实是导致损伤的主要原因。
研究还验证LK-2能够穿透小鼠血脑屏障达到有效浓度,显示出良好的药代动力学特性。另外,转棒实验结果显示,在缺血性卒中小鼠模型(MCAO)中,LK-2治疗的小鼠运动学习和协调能力有显著改善,表现接近正常小鼠。
《自然》:发现缺血性卒中脑损伤全新机制,并发现治疗新思路
使用LK-2靶向ASICs上的谷氨酸结合位点具有神经保护作用
以上结果表明,LK-2作为离子通道ASICs的竞争性拮抗剂,可用于改善卒中后的神经损伤和功能恢复,而不影响NMDARs等其它通道的活性。这些发现有助于我们深入理解缺血性卒中引起的神经毒性机制,并为开发不依赖于NMDARs的新型卒中治疗方法提供指导。
参考文献:
[1]Lai, K., Pritišanac, I., Liu, ZQ. et al. Glutamate acts on acid-sensing ion channels to worsen ischaemic brain injury. Nature (2024). https://doi.org/10.1038/s41586-024-07684-7