
医学故事.红蓝融合 中华医学会理事 神经外科教授
肉芽肿性血管炎
肉芽肿性血管炎(Granulomatosis with Polyangiitis, GPA),曾被称为韦格纳肉芽肿(Wegener's granulomatosis, WG),是一种坏死性肉芽肿性血管炎,属于自身免疫性疾病。
疾病简介
该病于 1931 年由 Klinger 首次描述,1936 年由 Wegener 对其病理学进行了进一步阐述。病变累及小动脉、静脉及毛细血管,偶尔也会波及大动脉。病理特征为血管壁炎症,主要侵犯上、下呼吸道和肾脏。通常起始于鼻黏膜和肺组织的局灶性肉芽肿性炎症,进而发展为血管的弥漫性坏死性肉芽肿性炎症。临床表现常为鼻和副鼻窦炎、肺病变以及进行性肾功能衰竭。同时,还可能累及关节、眼、皮肤,甚至侵及眼、心脏、神经系统及耳等。无肾脏受累者被称为局限性肉芽肿性血管炎。
流行病学与病因
男性患者略多于女性,发病年龄范围广泛,从儿童到老年人均可能发病,中年人多发,40 - 50 岁是高发年龄段,平均年龄 41 岁。各种人种均可发病,但高加索人占比较高。我国的发病情况尚无确切统计资料。未经治疗的 GPA 病死率极高,达 90%以上,经激素和免疫抑制剂治疗后,预后显著改善。然而,目前该病尚无明确的独立致病因素,病因不明。
临床表现
GPA 表现多样,可累及多个系统,典型的 GPA 具有三联征:上呼吸道、肺和肾病变。
一般症状:起病方式有缓慢和快速进展之分。病初症状包括发热、疲劳、抑郁、纳差、体重下降、关节痛、盗汗、尿色改变及虚弱,其中发热最为常见,有时由鼻窦细菌感染引发。
上呼吸道症状:多数患者以上呼吸道病变首发,常见持续加重的流鼻涕,可导致上呼吸道阻塞和疼痛。伴有鼻黏膜溃疡和结痂、鼻出血、唾液带血,严重者会鼻中隔穿孔、鼻骨破坏形成鞍鼻。咽鼓管阻塞可引发中耳炎致听力丧失。
下呼吸道症状:肺部受累是基本特征之一,约 50%患者起病时就有肺部表现,80%以上患者在病程中会出现。常见症状为胸闷、气短、咳嗽、咯血、胸膜炎及肺内阴影。大量肺泡性出血少见,但一旦发生,会导致呼吸困难和呼吸衰竭。约 1/3 患者肺部影像学检查有肺内阴影,可能无临床症状。查体可有叩浊、呼吸音减低和湿啰音等体征。由于支气管内膜受累及疤痕形成,超过 55%的患者会出现阻塞性通气功能障碍,另有 30% - 40%的患者出现限制性通气功能障碍及弥散功能障碍。
肾脏损害:多数病例有肾脏病变,表现为蛋白尿、红白细胞及管型尿,严重时伴有高血压和肾病综合征,最终可致肾功能衰竭,是 GPA 的重要死因之一。无肾脏受累者称为局限型 GPA,部分患者起病时无肾脏病变,但病情进展可能发展为肾小球肾炎。
眼受累:眼受累比例较高,可达 50%以上,约 15%患者以此为首发症状。可累及眼的任何区域,表现为眼球突出、视神经及眼肌损伤、结膜炎、角膜溃疡、表层巩膜炎、虹膜炎、视网膜血管炎、视力障碍等。
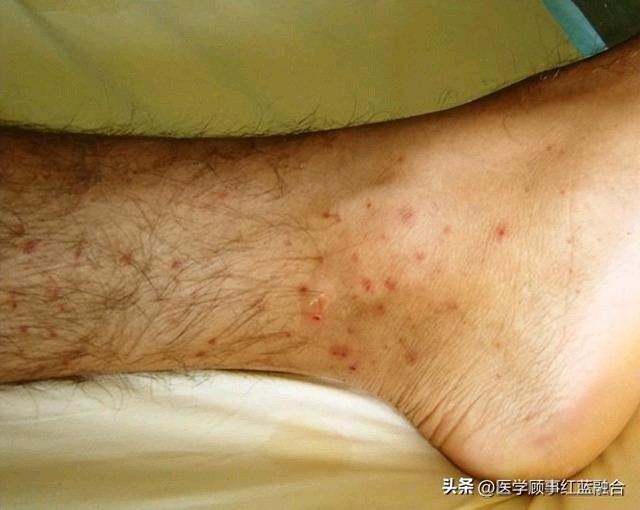
皮肤粘膜:多数患者有皮肤粘膜损伤,如下肢可触及的紫癜、多形红斑、斑疹、瘀点(斑)、丘疹、皮下结节、坏死性溃疡形成以及浅表皮肤糜烂等,其中皮肤紫癜最常见。
神经系统:很少有患者以神经系统病变首发,但约 1/3 患者病程中会出现。以外周神经病变最常见,多发性单神经炎是主要病变类型,表现为对称性末梢神经病变。肌电图及神经传导检查有助于诊断。
关节病变:关节病变较常见,发病时约 30%患者有关节病变,整个病程中约 70%患者关节受累。多为关节疼痛和肌痛,1/3 患者出现对称性、非对称性及游走性关节炎,可为单关节、寡关节或多关节的肿胀和疼痛。
其他:GPA 还可能累及心脏出现心包炎、心肌炎,胃肠道受累出现腹痛、腹泻及出血,尸检时可发现脾脏受损,泌尿生殖系统受累较少见,也有肉芽肿侵及脑垂体引发尿崩症的病例报道。
诊断
GPA 平均诊断时间为 5 - 15 个月。国外资料显示,40%的诊断在不到三个月得出,10%则需 5 - 15 年。早期诊断至关重要,无症状患者可通过血清学检查 ANCA 以及鼻窦和肺脏的 CT 扫描辅助诊断。上呼吸道、支气管内膜及肾脏活检是重要诊断依据,病理显示肺及皮肤小血管和类纤维蛋白变性,血管壁有中性粒细胞浸润,局灶性坏死性血管炎,上、下呼吸道有坏死性肉芽肿形成,肾病理为局灶性、节段性、新月体性坏死性肾小球肾炎,免疫荧光检测无或很少免疫球蛋白以及补体沉积。诊断困难时,必要时可行胸腔镜或开胸活检。目前 GPA 的诊断标准采用 1990 年美国风湿病学院分类标准:
鼻或口腔炎症:痛性或无痛性口腔溃疡,脓性或血性鼻腔分泌物。
胸片异常:胸片示结节、固定浸润病灶或空洞。
尿沉渣异常:镜下血尿(RBC>5/高倍视野)或出现红细胞管型。
病理性肉芽肿性炎性改变:动脉壁或动脉周围,或血管(动脉或微动脉)外区有中性粒细胞浸润。
符合 2 条或 2 条以上可诊断为 GPA,诊断的敏感性和特异性分别为 88.2%和 92.0%。
GPA 常被误诊,对有以下情况者应反复进行活组织检查:不明原因发热伴呼吸道症状;慢性鼻炎及副鼻窦炎,检查发现粘膜糜烂或肉芽组织增生;眼、口腔粘膜有溃疡、坏死或肉芽肿;肺内有可变性结节状阴影或空洞;皮肤有紫癜、结节、坏死和溃疡等。
鉴别诊断
GPA 由于可出现上、下呼吸道及肾脏相关症状,常需与鼻窦炎、鼻咽癌、淋巴瘤、肺炎、肺结核、肺癌、慢性肾炎等鉴别,还需与以下疾病区分:
显微镜下多血管炎:1993 年前曾作为 GPA 的亚型,目前认为是独立的系统性血管炎。主要累及小血管,可侵犯肾脏、皮肤和肺等脏器的小动脉、微动脉、毛细血管的小静脉,常表现为坏死性肾小球肾炎和肺毛细血管炎。累及肾脏时出现蛋白尿、镜下血尿和红细胞管型。抗中性粒细胞胞浆抗体(ANCA)阳性是重要诊断依据,60 - 80%为髓过氧化物酶(MPO)-ANCA 阳性,荧光检测法示外周型(p-ANCA)阳性,胸部 X 线检查早期可能无特征性肺部浸润影或小泡状浸润影,中晚期出现肺间质纤维化。
变应性肉芽肿性血管炎(Churg-Strauss 综合征):有重度哮喘;肺和肺外脏器有中小动脉、静脉炎及坏死性肉芽肿;周围血嗜酸性粒细胞增高。GPA 与变应性肉芽肿性血管炎均可累及上呼吸道,但前者常有上呼吸道溃疡,胸片示肺内有破坏性病变如结节、空洞形成,而在变应性肉芽肿性血管炎则不多见。GPA 病灶中很少有嗜酸性粒细胞浸润,周围血嗜酸性粒细胞增高不明显,也无哮喘发作。
淋巴瘤样肉芽肿病:是多形细胞浸润性血管炎和血管中心性坏死性肉芽肿病,浸润细胞为小淋巴细胞、浆细胞、组织细胞及非典型淋巴细胞,病变主要累及肺、皮肤、神经系统及肾间质,但不侵犯上呼吸道。
肺出血 - 肾炎综合征(Goodpasture syndrome):是以肺出血和急进性肾小球肾炎为特征的综合征,抗肾小球基底膜抗体阳性,引致的弥漫性肺泡出血及肾小球肾炎综合症,以发热、咳嗽、咯血及肾炎为突出表现,但一般无其它血管炎征象。本病多缺乏上呼吸道病变,肾病理可见基底膜有免疫复合物沉积。
复发性多软骨炎:以软骨受累为主,临床表现也可有鼻塌陷、听力障碍、气管狭窄,但该病一般均有耳廓受累,而无鼻窦受累,实验检查 ANCA 阴性,抗Ⅱ型胶原阳性。
治疗
治疗分为诱导缓解、维持缓解和控制复发 3 期。循证医学表明糖皮质激素加环磷酰胺联合治疗效果显著,特别是对于肾脏受累及有严重呼吸系统疾病的患者,应作为首选方案。未经治疗的 GPA 患者预后较差。
糖皮质激素:活动期用泼尼松 1.0 - 1.5 mg·kg-1·d-1,用 4 - 6 周,病情缓解后减量并以小剂量维持。对严重病例如中枢神经系统血管炎、呼吸道病变伴低氧血症如肺泡出血、进行性肾功能衰竭,可采用冲击疗法;甲基泼尼松龙 1.0 g/d×3 天,第 4 天改口服泼尼松 1.0 - 1.5mg/kg/d,然后根据病情逐渐减量。
免疫抑制剂环磷酰胺:通常每天口服 1.5 - 2 mg/kg,也可用 200mg,隔日一次。病情平稳者可用 1 mg/kg 维持。严重病例给予 1.0g 冲击治疗,每 3 - 4 周一次,同时每天口服 100mg。或每 2 周给予静滴 0.6g - 0.8g。环磷酰胺是治疗本病的基本药物,可使用一年或数年,撤药后患者能长期缓解。用药期间注意观察不良反应,如骨髓抑制等。硫唑嘌呤:为嘌呤类似药,有抗炎和免疫抑制双重作用,有时可替代环磷酰胺。一般用量为 1 - 4 mg. kg-1.d-1,总量不超过 200 mg/d。但需根据病情及个体差异而定,用药期间应监测不良反应。如环磷酰胺不能控制,可合并使用硫唑嘌呤或改用硫唑嘌呤。甲氨蝶呤:一般用量为 10 - 25mg,一周一次,口服、肌注或静注疗效相同,如环磷酰胺不能控制可合并使用之。环孢霉素 A:作用机理为抑制 IL-2 合成,抑制 T 淋巴细胞。优点为无骨髓抑制作用。但免疫抑制作用也较弱。常用剂量为 3 - 5mg/kg/d。吗替麦考酚酯:初始用量 1.5g/d,分 2 - 3 次口服,维持 3 月,维持剂量 1.0g/d,分 2 - 3 次口服,维持 6 - 9 月。丙种球蛋白:静脉用丙种球蛋白(IVIG)通过 Fc 介导的免疫调节作用,通过 Fab 干扰抗原反应或参与抗独特型抗体交叉作用而抑制抗体形成,抑制 T 淋巴细胞增殖及减少自然杀伤细胞的活性。大剂量丙球还具有广谱抗病毒、细菌及其他病抗体作用。一般与激素及其他免疫抑制剂合用,剂量为 300 - 400mg/kg/d,连用 5 - 7 天。化疗方案:对一些难治性患者,临床上试用用于淋巴瘤的 CHOP 化疗方案,有一定疗效。
其他治疗复方新诺明片(trimethoprim/sulfamethoxazole,SMZ Co):对于病变局限于上呼吸道以及已用泼尼松和环磷酰胺控制病情者,可选用复方新诺明片抗感染治疗( 2 - 6 片/日),认为有良好疗效,能预防复发,延长生存时间。在使用免疫抑制剂和激素治疗时,应注意预防卡氏肺囊虫感染所致的肺炎,约 6%的 GPA 患者在免疫抑制治疗过程中出现卡氏肺囊虫肺炎,并可成为 GPA 的死亡原因。生物制剂:利妥昔单抗即抗 CD-20 单克隆抗体可以清除 B 细胞,已证实该药能够诱导 ANCA 相关血管炎(包括 GPA、变应性肉芽肿性血管炎和显微镜下多血管炎)缓解。依那西普(Etanercept)对 GPA 无效。血浆置换:对活动期或危重病例,可用血浆置换治疗作为临时治疗。但需与激素及其他免疫抑制剂合用。急性期患者如出现肾衰则需要透析,55% - 90%的患者能恢复足够的功能。
对于声门下狭窄、支气管狭窄等患者可以考虑外科治疗。
预后
GPA 通过糖皮质激素加环磷酰胺联合治疗和严密随诊,能诱导和维持长期缓解。早期诊断和及时治疗可提高效果。过去,未经治疗的 GPA 平均生存期为 5 个月,82%的患者一年内死亡,90%以上患者两年内死亡。目前多数患者在正确治疗下能长期缓解。影响预后的主要因素是难以控制的感染和不可逆的肾脏损害,年龄 57 岁以上、血肌酐升高是预后不良因素。此外,ANCA 的类型对治疗反应和预后似乎无关,但有抗 PR3 抗体的患者若不治疗,病情可能更活跃、进展更迅速。故早期诊断、早期治疗,在肾功能损害前积极治疗,可明显改善预后。
护理
一级预防加强营养,增强体质。预防和控制感染,提高自身免疫功能。避免风寒湿,避免过劳,忌烟酒,忌辛辣食物。室外活动时保护眼用眼罩防护及鼻部。
二级预防:早期诊断,了解眼、鼻感染情况,做好临床观察,早期发现各个系统的损害,早期治疗,主要控制眼、鼻的感染。
三级预防:注意肺、肾、心及皮肤病变,并注意继发性金黄色葡萄球菌感染的发生。此外,神经系统、消化系统亦可能被累及。