
医学顾事红蓝融合 中华医学会理事 神经外科教授
神经系统同时主导着生物的发育和肿瘤学。在发育过程中,神经系统调控器官形成,维持体内稳态,并在整个生命过程中促进可塑性,它在肿瘤的调控中也起到了类似的作用。基础研究已揭示了神经元与癌细胞之间的直接旁分泌和电化学通讯,以及通过神经效应对肿瘤微环境中的免疫系统和基质细胞的间接交互,在多种恶性肿瘤中都有涉及。神经系统与癌症的相互作用可以调控癌症的起始、生长、侵袭和转移、治疗耐药性、促进肿瘤相关炎症以及损害抗癌免疫。肿瘤神经科学的进展可能为肿瘤治疗创造一个重要的新支柱。

Cell:肿瘤发展和神经系统密切相关
摘要
神经系统同时主导着生物的发育和肿瘤学。在发育过程中,神经系统调控器官形成,维持体内稳态,并在整个生命过程中促进可塑性,它在肿瘤的调控中也起到了类似的作用。基础研究已揭示了神经元与癌细胞之间的直接旁分泌和电化学通讯,以及通过神经效应对肿瘤微环境中的免疫系统和基质细胞的间接交互,在多种恶性肿瘤中都有涉及。神经系统与癌症的相互作用可以调控癌症的起始、生长、侵袭和转移、治疗耐药性、促进肿瘤相关炎症以及损害抗癌免疫。肿瘤神经科学的进展可能为肿瘤治疗创造一个重要的新支柱。
引言
考虑到神经系统在健康和疾病中对人体的广泛功能进行调控,令人有些惊讶的是,我们花了这么长时间才充分认识到它在癌症中的核心作用。中枢神经系统(CNS)和外围神经系统(PNS)都调节生理功能和病理生理过程。基于汇聚的证据,现在越来越多地被理解为CNS和PNS的活动调节多种组织的发育、器官形成、稳态、可塑性、再生和免疫功能¹,²。由于癌症的形成、生长和进展颠覆和重新定位了发育和再生的机制,神经系统可能涉及癌症病理生理的所有方面。相反地,癌症和癌症疗法可以影响和重塑神经系统,从而导致不仅产生神经功能障碍,还可能驱使恶性肿瘤的病理性反馈循环。这些新的认识导致了癌症神经科学作为一个新的学科的兴起³,该学科专注于在局部肿瘤微环境和全身性地定义和治疗性地靶向神经系统与癌症的相互作用。
在这篇综述中,我们将提供关于癌症神经科学的当前状态和未来方向的更新。我们确定了重要的未回答的问题和当前的障碍,明确了通过跨学科的技术、知识和学术基础设施的发展来克服这些障碍的方法。与神经系统的癌症相互作用得到了讨论,新的多学科研究子领域,如"neuro-immuno-oncology(神经-免疫-肿瘤学)",也得到了概述。重要的是,为实施神经科学指导的癌症治疗制定了临床转化的路线图。我们认为,癌症神经科学(图1)可以刺激两个领域:癌症研究和临床肿瘤学,以及神经科学和神经医学,在这些学科的交叉点上产生协同作用。
Cell:肿瘤发展和神经系统密切相关
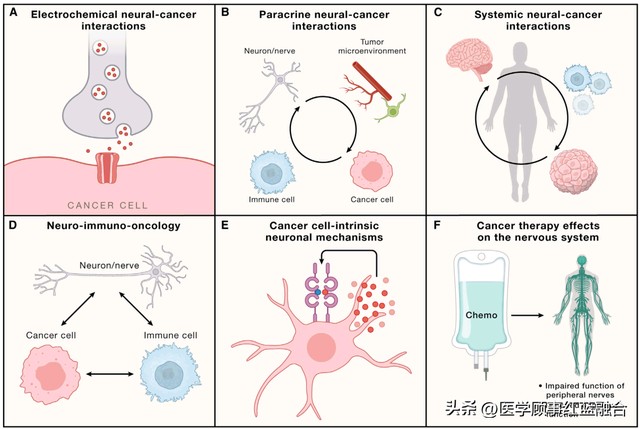
图 1. 神经系统与癌症的相互作用机制 神经系统(灰色)和癌症(红色)至少有六种相互作用方式。(A) 电化学相互作用,包括真正的神经元到癌细胞的突触。(B) 神经元/神经到癌细胞的旁分泌相互作用,直接或通过与肿瘤微环境中的细胞(显示为绿色的基质细胞和红色的血管)信号传导。反过来,癌细胞经常分泌信号分子,如突触生成因子或轴突生成因子,这些因子在局部重塑神经系统,增强神经系统与癌症的相互作用。(C) 系统性的神经系统-癌症相互作用,例如,可以直接或间接影响癌症发病机制的循环神经递质或神经肽,如通过改变免疫系统(蓝色)功能。相应地,癌症可以通过循环因子或改变传入神经信号在远处影响神经系统。(D) 神经元或神经、癌细胞和免疫细胞之间的三方相互作用可以调节抗癌免疫和促癌炎症。(E) 癌细胞可能利用与神经细胞传统相关的细胞内信号和其他过程。例如,描绘了自分泌神经营养因子信号传导。(F) 癌症治疗(化疗,绿色)可以深刻地改变神经系统功能,包括多种类型的外周神经的功能受损和认知功能受损。
神经系统对组织发育、稳态和可塑性的影响
神经活动影响器官的发育、稳态、可塑性和再生——无论是在中枢神经系统内还是在整个身体中都是如此。对于神经活动依赖性调节健康生理状态的细胞和分子基础的认识,可能为神经系统如何类似地影响肿瘤生物学提供见解。考虑到了解大脑本身的发育对于癌症神经科学的研究是多么有指导意义,我们首先深入讨论神经系统的发育,探索后面讨论的癌症发病机制中所反映的基本概念。
中枢神经系统
CNS的发育涉及从神经干细胞和前体细胞进行协调的神经元生成和胶质细胞生成;这些神经元、星形胶质细胞和少突胶质细胞的多样化;新细胞迁移到适当的位置;以及神经回路的组装(关于这点,参见Silbereis等人的综述⁴)。功能性神经回路的发育需要轴突的生长和寻路、突触的建立,以及神经元之间这些连接的完善。星形胶质细胞促进突触生成,在大脑中形成一个隙缝连接的网络,并与突触结合以支持突触功能,而少突胶质细胞为轴突形成髓鞘,提供代谢支持⁵并使动作电位快速跳跃传导⁶。
电活动影响神经系统发育的所有方面(关于这点,参见Spitzer的综述⁷)。在神经发育的早期阶段,同步的电活动波和随之产生的电压依赖性钙瞬变在发育中的神经组织中发生,调节细胞和突触的形态生成。在新生的大脑中,隙缝连接将生殖区的神经干细胞连接在一起,允许膜去极化诱导的钙瞬变同步地在生殖区中传播,调节干细胞的增殖⁸。在神经发育的早期,多种细胞类型以非突触的方式分泌神经递质,促进神经元的生成⁹。电活动还调节这些新生成神经元的迁移¹⁰,并影响轴突的寻路和轴突的定向¹¹-¹³。
在发育中的神经系统中,迁移的神经母细胞之间、产前和早期出生后的新皮质神经元之间,以及在许多其他神经解剖位置的神经元之间都发生隙缝连接¹⁴。这种连接,加上细胞去极化的机制,如非突触性的谷氨酸分泌和“起搏器”神经元¹⁷,使得同步的钙瞬变能够传播到发育中的CNS结构,如新生的新皮质¹⁸。最近的研究表明,一个小的、独特的神经元亚群在整个大脑中展开,提供一个特定的周期性信号,协调大脑的发育¹⁹。这种不依赖经验的、协调的活动波促进功能性神经回路的组装,随后在依赖经验的方式中得到完善²⁰,²¹。
神经递质信号调节大脑的器官发生,并在后来作为神经元之间突触通讯的基础。新神经元从干细胞和前体细胞的形成,以及它们整合到神经回路中,都是由发育期的神经递质驱动的(关于这一点,请参见Ojeda和A´vila的综述²²),以及在成年大脑的神经发生区域⁹。这种信号调节是微调的,可以在空间和时间上是异质的:例如,在发育过程中,神经递质GABA(在后期生活中是一种抑制性神经递质)主要是兴奋性的(去极化的),这是由于氯转运蛋白的发育表达模式,并涉及到许多神经发育的过程,包括神经元的增殖、迁移、分化和在CNS中的初步回路建立(关于这一点,请参见Ojeda和A´vila的综述²²),同时在早期胚胎发生过程中抑制神经母细胞的产生和外围神经嵴细胞²³。
在CNS中,细胞的可塑性并不在出生或儿童时期结束。与发育期间情况相同,神经元活动也在整个生命过程中调控持续的细胞可塑性。神经元活动和神经递质信号强烈调节神经前体细胞的增殖,包括髓鞘前体细胞(图2)²⁴,以及在脑室下区²⁵,²⁶和海马区的神经干细胞²⁷,²⁸。神经元活动驱动成年大脑可塑性和适应中的最重要特征:持续的髓鞘生成和重塑²⁴,²⁹,³⁰(图2),这有助于运动功能²⁴、运动学习³¹、注意力和短期记忆³²、记忆巩固³³,³⁴以及社交功能³⁵,³⁶。在健康状态下,适应性髓鞘化似乎是高度且特异性地调节的,具有精确的回路特异性和神经元亚型特异性²⁴,³⁷的活动调节的髓鞘变化,调节回路动态以促进协调的回路功能³³,³⁸,³⁹。
Cell:肿瘤发展和神经系统密切相关
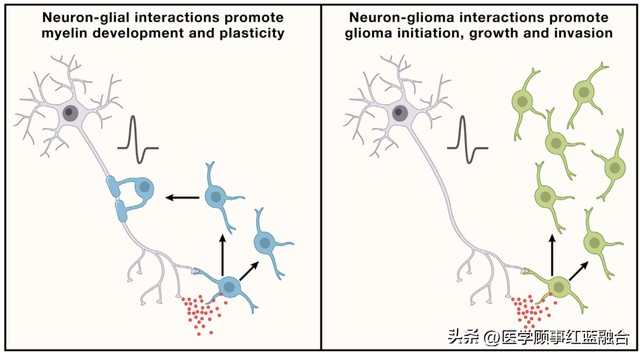
图 2. 胶质可塑性和胶质恶性病变的平行机制 左图:神经元(灰色)与少突胶质细胞(蓝色)之间的相互作用涉及神经元与少突胶质前体细胞的突触以及旁分泌(红色圆圈)信号传导,例如在发育过程中以及整个生命过程中的BDNF-TrkB信号传导。神经元活动可以促进少突胶质前体细胞的增殖,产生新的少突胶质细胞,并对髓鞘进行适应性的变化,从而调整神经回路的功能。髓鞘的这种可塑性在整个生命过程中为健康的认知功能作出贡献。右图:神经元与胶质瘤(绿色)之间的相互作用涉及神经元与胶质瘤的突触和旁分泌信号传导,例如BDNF-TrkB信号传导。胶质瘤对通常支持髓鞘发育、稳态和可塑性的机制的劫持,反而促进了胶质癌的起始、增长和侵袭。
神经元通过活动依赖性旁分泌因子,如脑源性神经营养因子(BDNF)³²,以及通过突触通讯(图2)与神经干细胞和前体细胞进行通讯。髓鞘前体细胞(OPCs)的突触信号已经得到确立,它们通过谷氨酸(钙透通AMPA受体介导)和GABAergic(GABAA受体介导)神经-胶质突触接收突触输入⁴⁰,⁴¹。这样的神经元到OPC的突触是单向的,OPC始终处于突触后位置,并可能是暂时性的⁴²,这与OPC的快速迁移相容。对OPC的突触输入是广泛的,涉及短程和长程输入⁴³,尽管这样的神经元到OPC的突触在活动调节的髓鞘化中可能扮演的角色仍然不完全清楚。
除了发育和可塑性,谷氨酸神经活动还在脱髓鞘损伤后促进髓鞘再生⁴⁴,⁴⁵。对OPCs的GABAergic信号参与对缺氧诱导的脱髓鞘化的抗性和适应性修复⁴⁶。值得注意的是,新的证据表明,在受伤后,不仅来自PNS的神经元,而且来自CNS的神经元都可以恢复到胚胎样的生长状态,从而允许轴突再生⁴⁷。总的来说,这说明CNS具有通过神经元活动调节的机制自我修复损伤的显著能力,至少在某种程度上。
神经活动也是CNS中血管稳态生理过程的重要调节因子。一个例子是大脑中的脑血流神经自动调节,称为神经血管耦合,它允许局部血流增加以根据需求迅速供应氧气和营养物质⁴⁸;这个过程涉及神经元、星形胶质细胞和血管细胞,并包括直接的神经递质信号⁴⁹。神经元活动还通过调节内皮基因表达和效应转运蛋白的功能直接调节血脑屏障⁵⁰。
外周神经系统
在整个身体中,神经支配同样调节组织发育、器官生成和再生,不仅仅在中枢神经系统 (CNS) 中(参考文献见 Boilly 等人¹ 和 Kumar 与 Brockes²)。CNS控制着大量的非神经细胞和身体功能,要么通过将激素分泌到全身循环,要么通过更具区域特异性的方式通过PNS,它通过交感(肾上腺素能)、副交感(胆碱能)、运动和/或感觉神经纤维将CNS连接到所有器官。
神经在发育中的作用日益受到重视,器官的形成依赖于适当的神经支配。两栖动物和爬行动物的四肢再生长期以来都被认为是不可或缺地依赖于功能正常的神经和不受干扰的神经生长⁵¹。在哺乳动物中,也报道了器官生成对神经支配的类似依赖性。以唾液腺为例,其对副交感神经支配至关重要⁵²。同样,去神经作用会损害新生小鼠的心脏再生⁵³,而心脏的器官生成依赖于交感神经系统的信号⁵⁴。一个令人兴奋的问题是,是否存在在身体的某些非神经细胞和神经元之间的突触或类似突触的结构。这个问题的答案对癌症神经科学也具有重要意义,并将帮助阐明从神经发育过程的角度看神经元与肿瘤的相互作用。
组织干细胞微环境的神经支配也调节了各种细胞类型的功能,无论是在发育期还是在成熟组织中,如皮肤⁵⁵-⁵⁷、胃肠道⁵⁸和骨髓⁵⁹所示。此外,Schwann细胞,PNS的主要胶质细胞类型,参与维持骨髓微环境中的造血干细胞⁶⁰。
神经系统在整个身体中都对组织再生有所贡献。受伤的成体器官在去神经后不会再生,而在唾液腺组织中恢复乙酰胆碱能信号功能可以改善上皮再生⁶¹。同样,伤口愈合过程中的表皮再生依赖于神经来源的刺猬蛋白信号,从而使毛囊干细胞转化为表皮干细胞⁵⁶。如下文详细讨论的,神经系统也参与调控免疫系统的多种功能(参见Schiller等人的综述⁶²)。此外,神经还控制外周的血管:在发育和组织修复过程中,血管和神经使用类似的信号和原理进行分化、生长和导向其目标。交感神经递质的释放在这些过程中的新血管形成中起到了作用⁶³。此外,血管的交感神经支配可以通过调控它们的黏附分子的表达,影响免疫细胞从血管到局部组织的渗出⁶⁴,从而影响局部免疫应答。
总的来说,CNS和PNS不仅参与认知功能、运动和感觉,而且还调控组织和器官的生成、适应、可塑性和修复。局部(旁分泌)和全身神经因子、神经元之间的经典突触接触,以及与非成熟神经元的真正突触接触,都参与了这一复杂、多层次的调控系统。这解释了为什么神经-癌症相互作用如此引人入胜地进行研究,因为上述描述的神经活动的所有"非典型"生物学功能对癌症也同样非常相关:即,器官(/肿瘤)生成;通过激活发育程序的生长;侵袭和殖民;控制一个许可的微环境,包括血管和免疫系统;以及韧性和自我修复能力。
CNS癌症神经科学
脑肿瘤生长和启动的旁分泌信号
如上所述,神经活动控制着广泛而多样的生理功能。与此同时,神经系统的活动和神经机制可以控制脑肿瘤的起始、生长、侵袭和大脑的转移性殖民化。首次提出神经元可能在脑肿瘤生物学中起关键作用的想法是在1938年的组织学共定位研究中⁶⁵,而现代神经科学工具的应用已明确证明神经活动可以驱动脑癌生长⁶⁶(图2)。
Cell:肿瘤发展和神经系统密切相关
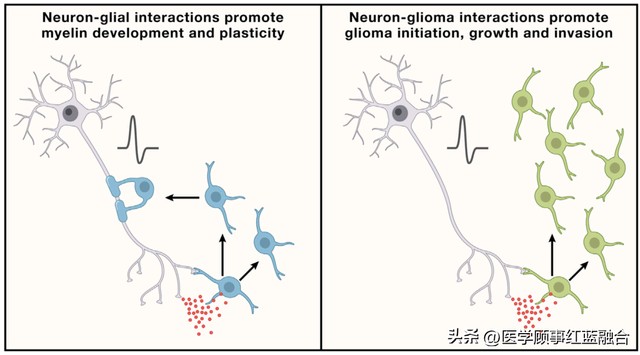
图 2. 胶质可塑性和胶质恶性病变的平行机制 左图:神经元(灰色)与少突胶质细胞(蓝色)之间的相互作用涉及神经元与少突胶质前体细胞的突触以及旁分泌(红色圆圈)信号传导,例如在发育过程中以及整个生命过程中的BDNF-TrkB信号传导。神经元活动可以促进少突胶质前体细胞的增殖,产生新的少突胶质细胞,并对髓鞘进行适应性的变化,从而调整神经回路的功能。髓鞘的这种可塑性在整个生命过程中为健康的认知功能作出贡献。右图:神经元与胶质瘤(绿色)之间的相互作用涉及神经元与胶质瘤的突触和旁分泌信号传导,例如BDNF-TrkB信号传导。胶质瘤对通常支持髓鞘发育、稳态和可塑性的机制的劫持,反而促进了胶质癌的起始、增长和侵袭。
活动调节的旁分泌信号机制首次被认识到是与神经元活动依赖的神经联蛋白-3(NLGN3)、BDNF和GRP78⁶⁶-⁶⁸的旁分泌信号有关,这促进了胶质瘤的增殖和生长。最近的数据显示,神经活动甚至可以驱动CNS肿瘤的起始⁶⁷。除了促进胶质瘤的生长外,NLGN3还调控了一种癌症易感综合症中视网膜胶质瘤的起始⁶⁷。NLGN3的活动依赖性脱落是由金属蛋白酶ADAM10介导的,而在小鼠模型中,使用ADAM10抑制剂显著减少了高级和低级胶质瘤的生长⁶⁷,⁶⁹。最近,IGF-1被确定为另一个神经活动调节的旁分泌信号分子,它介导嗅觉感觉体验依赖性的嗅球高级胶质瘤的起始⁷⁰。总的来说,这些发现表明,特定电路的神经活动依赖性旁分泌信号不同地影响了不同脑肿瘤类型的神经生物学。
神经元与脑肿瘤细胞之间的突触连接
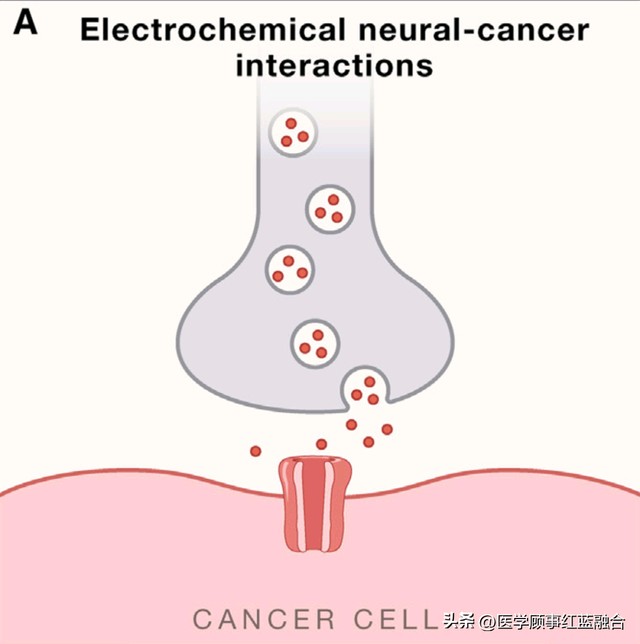
脑肿瘤细胞可以在结构上和电学上整合到神经回路中。相应地,来自各种成人和儿童胶质瘤类型的肿瘤细胞与神经元形成真正的谷氨酸突触(图1A),驱动肿瘤生长⁷¹,⁷²和大脑侵袭⁷³。
Cell:肿瘤发展和神经系统密切相关
(A) 电化学相互作用,包括真正的神经元到癌细胞的突触。
这些突触连接始终从突触前侧的神经元单向形成到突触后侧的胶质瘤细胞,诱导由胶质瘤细胞中的钙透过的AMPA受体(AMPAR)主要介导的兴奋性突触后电流(EPSCs)⁷¹,⁷²。这些EPSCs是去极化的,直接的光遗传学去极化胶质瘤细胞增加胶质瘤细胞的增殖⁷¹。此外,遗传或药理学地抑制AMPAR功能,使用已经FDA批准的抗癫痫药物perampanel,都可以减少胶质瘤细胞的增殖和侵袭⁷¹-⁷³。如上所述,少突胶质前体细胞(OPCs),许多类型的胶质瘤的可能起源细胞,以及未成熟的神经元也接收突触输入¹⁰,⁴⁰,表明恶性突触接触的生理相关性是存在的。
与直接的真正突触互动不同,间接的、突触周围的接触——这让人想起星形胶质细胞在三重突触中通常所扮演的位置——在乳腺癌脑转移瘤⁷⁴以及成人胶质母细胞瘤中都有发现⁷²。在乳腺癌脑转移疾病中,通过这些突触周围结构的谷氨酸盐信号途径通过乳腺癌细胞上的NMDA受体促进肿瘤生长⁷⁴。
将旁泌和突触机制联系起来,NLGN3在胶质瘤细胞中诱导突触生成的基因表达特征,这暗示它可能作为恶性突触生成的上游调节因子⁶⁹。的确,在肿瘤微环境中没有NLGN3时,神经元到胶质瘤的突触形成较少⁷¹。旁泌BDNF信号也促进神经元与胶质瘤细胞之间的突触连接,并调节恶性突触的强度⁶⁸。与支持健康大脑中的学习和记忆的生理突触的可塑性类似,BDNF增加了胶质瘤细胞表面的AMPA受体流通,突显了一个恶性突触可塑性的突触后机制⁶⁸。反过来,这一机制放大了胶质瘤细胞中谷氨酸诱导的内向电流,并随后增加钙瞬变。在患者来源的胶质瘤细胞中,NTRK2(BDNF受体TrkB)的遗传或药理学抑制一致性地降低胶质瘤细胞对谷氨酸的反应性,减少神经元到胶质瘤的突触连接,并降低神经元活动诱导的胶质瘤增殖⁶⁸。因此,在胶质瘤中药理学地靶向TrkB信号抑制鼠模型中的肿瘤生长,而没有TrkB融合⁶⁸,突显出Trk抑制剂可能有比只用于表达Trk融合的胶质瘤更广泛的适应症。
脑瘤诱导的神经环境改变
已经确定了多种机制,通过这些机制,胶质瘤影响其神经微环境。由神经元高度兴奋性引起的癫痫在胶质瘤和脑转移瘤中都很常见。几种旁泌因子和异常增加的神经元突触生成都为胶质瘤诱导的神经元高度兴奋性作出了贡献。通过xc-半胱氨酸-谷氨酸转运体系统的旁泌谷氨酸分泌增加了神经元的高度兴奋性以及成人胶质母细胞瘤模型中的胶质瘤生长⁷⁵。在IDH-WT成人胶质母细胞瘤的肿瘤微环境中,GABA能中间神经元的丧失也导致了电路的高度兴奋性⁷⁶,胶质瘤引起的神经元氯转运体表达的改变也是如此,这改变了GABA从抑制性到兴奋性的效应⁷⁶。另一个有趣的促进神经元高度兴奋性的机制是胶质瘤细胞促进突触生成的能力,这反映了星形胶质细胞的生理作用⁷⁷。在具有酶PIK3CA的特定点突变的胶质瘤中,胶质瘤细胞分泌的glypican-3驱动异常的突触生成和鼠模型中的相关神经元高度兴奋性⁷⁸,表明胶质瘤的不同基因特征可以差异性地影响神经元肿瘤微环境。此外,胶质瘤分泌的thrombospondin-1,另一个突触生成因子,促进了肿瘤和大脑之间的增加的功能性神经连接;与胶质母细胞瘤的人的生存期强烈相关的是肿瘤的这种功能性连接⁷⁹。
总的来说,这些数据突显了神经元高度兴奋性、神经元-胶质瘤互动和脑瘤进展之间的正反馈回路。这一概念得到了最近的临床数据的加强,这些数据将特定活跃的大脑区域与胶质瘤的发生联系起来⁸⁰。
脑癌生物学中的肿瘤自主的神经发育和神经机制
除了神经元-肿瘤网络外,脑肿瘤细胞本身也表现出多种神经和神经发育特征,包括网络结构(图1E)。
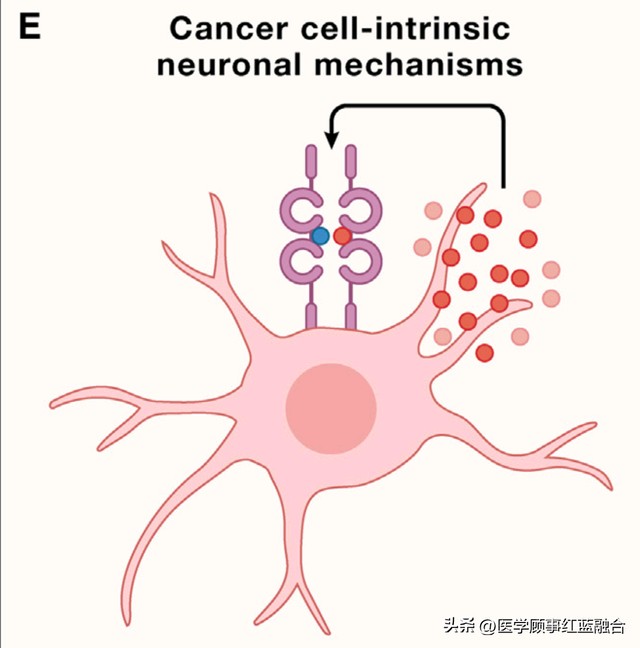
Cell:肿瘤发展和神经系统密切相关
(E) 癌细胞可能利用与神经细胞传统相关的细胞内信号和其他过程。例如,描绘了自分泌神经营养因子信号传导。
胶质瘤细胞用来扫描脑微环境的超长、类似神经纤维的膜突起被称为肿瘤微管(TMs)⁸¹,它们侵入脑部⁷³,⁸¹-⁸³并通过侵袭和细胞分裂殖民它⁸¹。随着时间的推移,TMs将单个胶质瘤细胞连接成一个功能性的、相互通信的多细胞网络⁷³,⁸¹。到目前为止,人类胶质瘤中一直存在TMs和它们产生的多细胞网络,包括2-4级星形细胞瘤(其中包括4级胶质母细胞瘤)和K27M突变的中线胶质瘤⁷¹,⁷²,⁸¹-⁸⁵。如前所述,TMs与神经突起之间存在许多相似之处。侵袭性TMs的亚种群展示了与神经突起的生长锥相似的尖端,神经突起是神经发育过程中的神经元过程,对于神经元迁移路径查找和网络建设至关重要⁸¹,⁸²。此外,TMs的与侵袭有关的特性,如分支、突起和收缩模仿了神经纤维路径查找的机制⁷³。TM生长的几种分子驱动因子也参与了神经纤维生长和神经发育,如GAP-43和TTYH1⁸¹,⁸³。
通过使用TMs之间的缝隙连接(主要是connexin 43)和粘附连接,肿瘤细胞彼此相互连接,构建了肿瘤-肿瘤网络的解剖基础。通过缝隙连接相互连接的肿瘤细胞网络通过细胞间钙波进行通信,并与彼此交换小分子,这类似于大脑中的生理星形胶质细胞网络⁷¹,⁸¹,⁸⁶。重要的是,这种功能性的肿瘤-肿瘤网络是介导治疗耐药性的关键因素。通过TM网络集成,缝隙连接耦合的肿瘤细胞主要对放疗和标准的替莫唑胺化疗产生耐药性。相比之下,未连接的胶质瘤细胞对细胞毒性治疗的反应要强得多,这与肿瘤细胞内稳态的减少有关⁸¹,⁸⁵,⁸⁷,⁸⁸。这类似于正常大脑星形胶质细胞网络的机制,它们可以在其缝隙连接耦合的网络中稀释有毒代谢物⁸⁹。此外,肿瘤细胞通过缝隙连接和TMs不仅与彼此相互连接,而且还与大脑的星形胶质细胞网络相互连接,这也已经证明对于癌细胞在转移过程中的大脑中的存活至关重要⁷³,⁹⁰。
相比之下,尚未(或还未)融入肿瘤-肿瘤或肿瘤-星形胶质细胞网络的胶质母细胞瘤细胞是胶质母细胞瘤侵袭的驱动因子⁷³。在分子层面,这一亚种群富集了类似髓鞘生成前体细胞(OPC-like)、神经前体细胞(NPC-like)和神经元样细胞状态。有趣的是,侵袭性的胶质母细胞瘤细胞亚种群显示了与神经发育期间的不成熟神经元相似的迁移模式。此外,与接受突触输入的不成熟神经元和OPC相似,神经元刺激后胶质瘤细胞的侵袭以及TM动态和TM生成都增加了⁷³。
总之,互相连接的胶质瘤细胞介导治疗耐药性,而那些未与其他细胞或星形胶质细胞相连接的细胞则推动大脑入侵。换句话说,不同的神经特性决定了侵袭性脑肿瘤的各种核心恶性特征。
最近发现,通过TM连接的胶质母细胞瘤细胞网络的特点是由起搏器样肿瘤细胞产生的自主节律活动。这些自主节律的肿瘤细胞位于功能性肿瘤网络的中心,通过产生在整个网络中传播的细胞内Ca2+波有效地影响其他网络成员⁹¹。除了也产生Ca2+活动的神经元对胶质瘤突触信号,包括胶质瘤网络中的Ca2+波⁷¹,⁷²,这种周期性活动是胶质瘤网络激活的另一种自主机制。重要的是,胶质母细胞瘤的生长和细胞存活依赖于这种自主节律活动,可能是通过特定频率上调的明确的促肿瘤细胞内途径⁹¹。对于癌症神经科学领域而言,这些发现与神经发育期间由起搏器样神经元细胞驱动的自发性周期性网络活动具有惊人的相似性:关于频率、起搏的分子机制(Ca2+调节的钾导电性)、网络发展的重要性、种群活动的协调,以及起搏器样行为的可塑性甚至“自修复”特性¹⁷。了解其他肿瘤类型是否通过再现这种生理神经发育原理展现类似的病理生物学机制将是有趣的。
肿瘤和中枢神经系统(CNS)之间的各种组件的相互作用的复杂性(图3)揭示了未来的一个重要挑战。除了决定脑癌生物学的各种神经机制外,对肿瘤细胞中表达的离子通道、神经-肿瘤共同调节的血-脑屏障和肿瘤血管生物学的研究,以及其他研究线都将进一步扩展我们在脑肿瘤癌症神经科学中的知识。
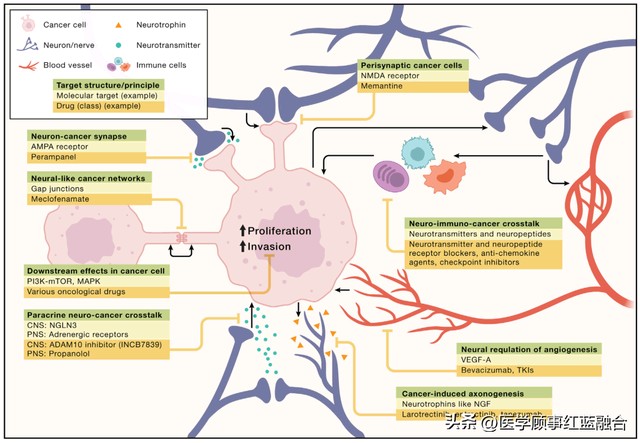
Cell:肿瘤发展和神经系统密切相关
图 3. 神经科学与癌症生物学交叉点的治疗机会 对神经系统与癌症交流的增加理解开始阐明了各种癌症的治疗靶点。尽管这些靶点在肿瘤特异性方面有所不同,但这里展示了靶点结构或原理(绿色)、相关的分子靶点(黄色),以及可能对治疗有用的药物或药物类(橙色)的例子。请注意,这里只显示了一些例子,每个靶点并不一定适用于每一种肿瘤类型;例如,使用抗癫痫药物parampanel靶向AMPAR介导的突触至今只被证明是胶质瘤的潜在策略。每种治疗策略都需要在前瞻性临床试验中进行测试,其中几个例子已经启动了这些测试(参见文中内容)。
PNS(外周神经系统)癌症神经科学
除了中枢神经系统(CNS),现在许多关于不同癌症类型的研究都证明了神经系统在驱动大脑以外癌症的肿瘤发病机制中的基础作用。与胶质瘤一样,病理学家已经认识到神经元和周围恶性细胞之间的结构关系已有一百多年的历史,⁹²这主要是由于观察到的神经周围侵袭(PNI)⁹³,这暗示神经周围的生态位可能对肿瘤有功能上的益处。PNI涉及恶性细胞包围或侵入神经束,并且已经与多种不同癌症的侵袭性和不良预后相关,包括胰腺癌、乳腺癌和前列腺癌⁹⁴-⁹⁶。与胶质瘤一样,已发现多种非CNS肿瘤的癌细胞在基因表达水平上显示出明显的神经发育特征⁹⁷。
临床前研究已经证明自主神经