
学术君 生物岛 2022-09-18 23:13 发表于上海
编者按
雌激素和雌激素受体α (ERα) 诱导的基因转录与 ERα 阳性乳腺癌发生密切相关。ERα占据的增强子,特别是超级增强子,已被认为在调节此类转录事件中起着至关重要的作用。然而,ERα 占据的超级增强子 (ERSE) 以及与 ERSE 相关的关键 ERα 诱导的靶基因仍有待充分表征。
2022年9月17日,厦门大学刘文及赣南医学院张文娟共同通讯在Nucleic Acids Research(IF=19)在线发表题为“Super-enhancer-controlled positive feedback loop BRD4/ERα–RET–ERα promotes ERα-positive breast cancer ”的研究论文,该研究定义了 ERα 阳性乳腺癌细胞系中 ERSE 的分布,并证明Bromo结构域蛋白 BRD4 是 ERSE 和同源 ERα 靶基因转录激活的主要调节因子。RET 是酪氨酸蛋白激酶家族的成员,被鉴定为 BRD4 调节的 ERSE 的关键 ERα 靶基因,反过来通过激活 RAS/RAF/MEK2/ERK/p90RSK/ERα 磷酸化级联反应对于 ERα 诱导的基因转录激活和恶性表型至关重要。
与标准内分泌治疗他莫昔芬相比,BRD4 和 RET 抑制剂的联合治疗在体外和体内均表现出抑制 ERα 阳性乳腺癌的累加作用。此外,联合治疗使抗他莫昔芬的 ERα 阳性乳腺癌细胞系对他莫昔芬治疗重新敏感。总之,该研究数据揭示了构成 BRD4/ERα-RET-ERα 在 ERα 阳性乳腺癌中的超级增强子相关正反馈回路的关键作用,并建议靶向该循环中的成分将为临床治疗ERα阳性乳腺癌提供新的治疗途径。

乳腺癌已超过肺癌成为最常见的诊断癌症,2020 年估计有 230 万新病例 。乳腺癌分为五种亚型,即luminal A、luminal B、HER2阳性、基底样和正常样。Luminal A 和 B 亚型一起属于所谓的雌激素受体 (ER) 阳性组,其具有最异质的拷贝数变化、基因表达模式、突变谱和患者结果。ER 阳性乳腺癌的一线治疗是内分泌治疗,包括选择性 ER 调节剂 (SERM)(例如他莫昔芬)、芳香酶抑制剂(例如来曲唑)和选择性 ER 下调剂 (SERD)(例如氟维司群)。然而,内分泌治疗存在众多和普遍的副作用,例如潮热、关节痛、盗汗以及对骨骼和性健康的影响。ER+ 转移性乳腺癌不可避免地会出现对内分泌治疗的耐药性。
寻找更有效的治疗方法来克服内分泌治疗耐药性仍然是乳腺癌领域的一个具有挑战性的课题。ERα依赖性转录在ER阳性乳腺肿瘤发生中起关键作用,这需要各种转录因子、表观遗传酶、表观遗传阅读器和染色质重塑剂之间高度协调和复杂的相互作用。这些 ERα 辅因子代表了 ERα 阳性乳腺癌的一类有希望的治疗靶点。
超级增强子 (SE) 是一大群增强子,它们驱动与细胞身份和疾病相关的基因表达。SE 和 SE 相关基因已被证明对癌症发展至关重要。BRD4 是Bromo结构域和末端外 (BET) 蛋白家族的成员,已被证明在人类疾病中发挥关键作用,例如癌症、心血管疾病、炎症性疾病和中枢神经系统 (CNS) 疾病。作为一般转录机制的一部分,BRD4 在转录起始位点 (TSS)、典型的增强子和 SE 区域富集,在这些区域它充当表观遗传阅读器以识别组蛋白尾部上的乙酰化赖氨酸,并通过募集转录延伸因子 b (P-TEFb)来调节转录。
BRD4 占据的 SE 已在不同类型的癌症中得到表征,其驱动大量致癌基因的表达以促进癌症发展。此后,已经开发出大量针对 BRD4 的小分子抑制剂。JQ1 是第一个报道和研究最多的 BET 家族抑制剂,可以竞争性结合乙酰赖氨酸识别基序或Bromo结构域。还报道了其他 BRD4 抑制剂,包括 CPI203、MS417和 OTX015。双 BET 激酶抑制剂对 JAK2 驱动的细胞系和骨髓增生性肿瘤 (MPN) 患者的造血祖细胞的肿瘤生长有效。用于治疗肝细胞癌和神经母细胞瘤的磷脂酰肌醇 3-激酶/BRD4 抑制剂 SF1126 的 I 期研究已获得 FDA 批准。
尽管 BET 抑制剂是治疗癌症的有前途的治疗剂,但副作用和获得性耐药性的迅速出现需要研究联合疗法。例如,BRD4 抑制剂与 HDAC 抑制剂联合使用可抑制多种肿瘤模型的生长并诱导细胞凋亡,包括乳腺癌 、急性髓性白血病 、胰腺导管腺癌、神经母细胞瘤和皮肤 T 细胞淋巴瘤。BET 抑制剂 OTX015 和蛋白酶体抑制剂卡非佐米在 TERT 重排神经母细胞瘤中协同诱导细胞凋亡 。
当与 BET 抑制剂 ABBV-075 和 BCL2 抑制剂共同治疗时,在小细胞肺癌 (SCLC) 中观察到强协同作用。与 JQ1 和 CDK7 抑制剂 THZ1 共同治疗会损害细胞增殖,并在头颈部鳞状细胞癌中诱导细胞凋亡和衰老。JQ1 在胶质母细胞瘤 (GBM) 中克服了 CAR-T 细胞疗法诱导的免疫抗性。同样,与靶向 BRD4 和 BRD4 下游靶基因的抑制剂的联合治疗也将代表治疗癌症的有效方法。
RET是一种跨膜受体,是酪氨酸蛋白激酶家族的成员。一般来说,RET 复合物包含一个二聚化的 RET 受体、一个胶质细胞衍生的神经营养因子 (GDNF) 家族配体和两个 GDNF 家族受体 α (GFRα) 共受体。当配体与 GFRα 结合时,RET 会发生二聚化和随后的磷酸化,从而激活不同的细胞内信号级联。RET 在肾器官发生和肠神经发生中起关键作用。
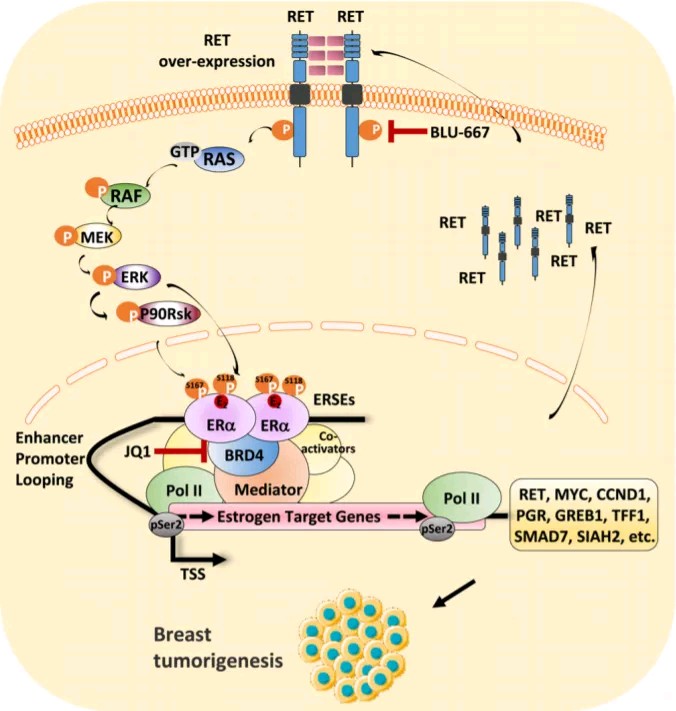
文章模式图(图源自Nucleic Acids Research )
RET 过表达、融合和突变已被表征为各种癌症类型的致癌驱动因素,显示出作为治疗靶点的巨大潜力。RET 表达由雌激素诱导,并且 RET 信号增强了乳腺癌中雌激素驱动的增殖。最近,两种 RET 特异性、突变有效的抑制剂 BLU-667(Pralsetinib)和 LOXO-292(Selpercatinib)被 FDA 批准用于治疗非小细胞肺癌(NSCLC)和甲状腺癌。
在该研究中,定义了多个 ERα 阳性乳腺癌细胞系中 ERα 占据的 SEs (ERSEs) 的景观,并证明 BRD4 对于 ERSEs 和同源 ERα 靶基因的转录激活至关重要。此外,RET被鉴定为BRD4的关键下游靶基因,促进ERα阳性乳腺癌细胞的恶性表型。BRD4和RET抑制剂的联合治疗在体外和体内均能有效抑制ERα阳性乳腺癌细胞的生长。
参考消息:
https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gkac778/6702595zl