
选自:中华妇产科杂志2022年7月第57卷第7期

子宫内膜息肉是常见的子宫内膜良性病变之一,可发生于青春期后的任何年龄,患病率随年龄增加而增高,其常见症状为异常子宫出血、不孕,或无明显症状。本临床诊疗路径以循证医学证据为基础,以临床规范诊疗为目的,建立从子宫内膜息肉高危因素的识别、临床诊断、病理分型到治疗再到患者的长期管理、宣教的诊疗流程路径,给予临床医师共识性的指导建议,旨在为广大妇产科医师提供子宫内膜息肉临床诊疗的可行性和规范性流程。
子宫内膜息肉是常见的子宫内膜良性病变之一,表现为局部子宫内膜腺体和间质的过度生长,突出于周围子宫内膜的增生性病变[1]。常见症状为异常子宫出血、不孕,或无明显症状、体检时超声检查偶然发现。子宫内膜息肉可发生于青春期后的任何年龄;患病率随年龄增加而增高,围绝经期最高。子宫内膜息肉的患病率因人群不同而异,成年女性子宫内膜息肉患病率为7.8%~34.9%[2];不孕人群中子宫内膜息肉占6%~32%[3];绝经前异常子宫出血患者中10%~40%发现有子宫内膜息肉[2]。
就诊患者应详细收集相关病史,并进行高危因素的筛查,子宫内膜息肉发病的高危因素见表1。注意患者的主诉及临床症状,对于存在异常子宫出血的患者应询问出血过程,记录末次月经和前次月经情况,注意出血量、出血性质、是否合并其他不适;不孕患者注意询问既往孕产情况,排除其他导致不孕的病因。注意既往史和手术史,如多囊卵巢综合征、高血压、糖尿病、长期应用他莫昔芬病史、宫腔操作史或宫腔机械刺激等,注意是否存在长期应用性激素治疗等高危因素。家族史注意是否合并结直肠息肉、Lynch综合征等遗传病。

1. 全身检查:注意患者的身高、体重,计算体质指数(BMI)及腰臀比。有无多囊卵巢综合征的临床表现,如多毛、痤疮、黑棘皮征等。
2. 妇科检查:有性生活者,妇科检查时观察子宫颈口有无息肉样赘生物。如患者有异常出血症状,妇科检查需评估出血来源。
1. 影像学检查:
(1)超声检查:经阴道超声检查为子宫内膜息肉的首选检查方法。无性生活者可选经直肠超声检查。对于经阴道超声检查无法明确诊断者,结合宫腔内生理盐水输注超声、静脉超声造影、腔内三维超声,可对明确诊断有进一步的帮助[3]。
(2)CT 及MRI 检查:CT 及MRI 检查对子宫内膜息肉的诊断帮助不大,但在子宫内膜息肉与其他宫腔内病变尤其是子宫腺肌瘤样息肉及子宫内膜癌的鉴别方面有一定的帮助。
2. 即诊即治的宫腔镜检查术:宫腔镜检查及镜下去除息肉行病理检查是诊断子宫内膜息肉的“金标准”方法。
1. 子宫内膜息肉的组织病理学诊断:至少应具备以下3条中的2条[4]:
(1)息肉内腺体及间质表现与周围内膜组织不同步;
(2)腺体排列方式不规则;
(3)间质纤维化及出现了厚壁血管成分。
2. 子宫内膜息肉的病理分型[4]:根据子宫内膜息肉的发生机制以及临床病理特征,子宫内膜息肉分为以下类型。
(1)非功能性子宫内膜息肉:部分息肉局灶可伴有子宫内膜增生(单纯性或复杂性增生),因而也被称为增生型息肉。这类息肉的发生可能与无拮抗的雌激素持续暴露有关,去除后极易复发。
(2)功能性子宫内膜息肉:息肉形态随着月经周期发生变化,部分息肉可以在月经期脱落,间质也可在大量孕激素作用下发生蜕膜样变。
(3)子宫腺肌瘤样息肉:息肉间质中出现较多的平滑肌成分,血管也更为明显,当其腺体出现异型时,则称为非典型腺肌瘤样息肉。
(4)他莫昔芬相关性息肉:发生于乳腺癌他莫昔芬治疗患者,去除后易复发,部分息肉病变可伴有非典型增生及恶变,以子宫内膜样癌为主,也有Ⅱ型子宫内膜癌的报道。
(5)绝经后子宫内膜息肉:见于绝经后妇女,息肉间质丰富;70%的老年性子宫内膜息肉腺体伴有不同程度的增生,部分腺体可囊性扩张,息肉周围子宫内膜呈现绝经后萎缩表现。
子宫内膜息肉中的非功能性息肉、腺肌瘤样息肉及绝经后息肉的恶变率高于功能性息肉。非功能性息肉和腺肌瘤样息肉在绝经前的恶变多为Ⅰ型子宫内膜癌,而绝经后息肉的恶变多为Ⅱ型子宫内膜癌,绝经后息肉恶变者的预后更差[5]。
1. 期待治疗:6.3%~26.7% 的子宫内膜息肉可自行消退[6‑9];甚至绝经后息肉也有自然消退的可能,但消退率低于绝经前患者[6‑7],鉴于子宫内膜息肉的恶变风险及恶变后预后不良,不建议绝经后息肉患者期待治疗[3]。对于无症状的绝经前患者,如合并1个发病高危因素、或息肉直径较大(>10 mm)应考虑行子宫内膜息肉去除术[3]。以下类型患者可在充分告知风险并知情同意的情况下考虑期待治疗,但期待治疗时限不建议超过1年。
(1)息肉直径≤10 mm[2,10]、无症状;
(2)绝经前患者,至少观察1个月经周期以排除功能性子宫内膜息肉的可能;
(3)存在手术或药物治疗禁忌证者。
2. 药物治疗:不建议单纯采用药物治疗。手术前用药主要用于区分是否为功能性子宫内膜息肉,或治疗息肉相关的异常子宫出血,手术后用药则重在管理子宫内膜,预防息肉复发。药物治疗最适于绝经前、直径<20 mm的子宫内膜息肉患者,合并异常子宫出血或子宫内膜增厚及存在手术禁忌证者。
常用药物包括孕激素类药物和复方口服避孕药(COC)[11]。通常,COC用药方案对子宫内膜的管理比后半周期孕激素治疗更强,因其可抑制性腺轴,有利于小的、多发的子宫内膜息肉消退。以慢性子宫炎为背景的子宫内膜息肉,给予标准的药物抗炎治疗也是有益的。
(1)用药方法:①后半周期孕激素撤退治疗[12]:相当于“药物性刮宫”。月经周期或撤退性出血第11~15天起,使用口服孕激素。具体用法:地屈孕酮:10~20mg/d,共10~14d;微粒化黄体酮:200~300mg/d,共10~14d;醋酸甲羟孕酮:4~10mg,每天1~2次,共10~14d。根据患者情况使用至少1个周期即可再次评估,建议在月经后尽早(周期第5~7天)行经阴道超声检查子宫内膜情况。如子宫内膜整体变薄,而息肉持续存在且直径>10mm,则建议宫腔镜手术治疗;如子宫内膜变薄、息肉消失,则可判断为功能性子宫内膜息肉,建议继续用药;如子宫内膜变薄,息肉缩小但未全部消失,可继续用药3~4个周期,或换用COC并观察疗效。②COC:按药物说明书周期性服用,对患者需要充分告知可能出现药物相关的突破性出血,指导患者耐心观察、规律用药,而且评估疗效的最短时限通常建议为3个周期及以上,除非在用药期间出现量似月经且较频繁的非预期出血,则应及时停药。静脉血栓家族史、吸烟患者(每天≥15支烟)、年龄≥35岁、肥胖患者(BMI>30 kg/m2)禁用COC[13]。
(2)禁忌证:以下情况是子宫内膜息肉药物治疗的禁忌证:①合并绝经后出血者;②合并不孕、反复流产以及拟行体外受精‑胚胎移植(IVF‑ET)的患者;③存在孕激素药物禁忌证者;④重度贫血患者。
3. 手术治疗:
(1)适应证:①有症状的子宫内膜息肉,如:经量增多、经期延长、经间期出血、同房出血、不孕、绝经后出血等;②直径>10 mm的子宫内膜息肉;③怀疑恶变的子宫内膜息肉,或存在恶变高危因素(包括年龄>60岁、绝经状态、肥胖、糖尿病、高血压、使用他莫昔芬[3])。在分析手术适应证时,要充分考虑子宫内膜息肉恶变的高危因素和患者的生育要求,遵循个体化原则。绝经后无症状的子宫内膜息肉患者因存在年龄和绝经状态的恶变高危因素,建议宫腔镜手术明确诊断[5,14]。
(2)禁忌情况:手术无绝对的禁忌证,除了健康状况无法耐受手术操作者。对于生殖道急性感染者,可以待感染控制后择期手术。
(3)子宫内膜息肉手术治疗指南[3]:
①宫腔镜子宫内膜息肉去除术仍然是治疗的“金标准”手术(A级)。
②不同宫腔镜息肉去除技术的临床结果并无显著差异(C级)。
③手术去除息肉并行组织病理学评估,适用于有症状的绝经后患者(B级)。
④对于合并不孕的子宫内膜息肉患者,建议手术去除息肉,这样有助于自然受孕或辅助生殖技术治疗时获得更大的受孕机会(A级)。
不建议盲刮法去除子宫内膜息肉[3]。
(4)手术方式:宫腔镜子宫内膜息肉去除术。
(5)手术时机:月经干净后2~7 d内手术视野最清晰,尽量避开经前期;本次月经周期无性生活;如因月经期延长就诊者,可以选择月经第7天后;如患者无规律月经,血净后可考虑手术;有不可控出血时可以急诊手术。
(6)手术技术:
①宫腔镜下子宫内膜息肉“冷刀”去除术。
②宫腔镜下子宫内膜息肉电切术。
③宫腔镜宫内组织粉碎法子宫内膜息肉去除术。
④宫腔镜子宫内膜去除术(适应证:有药物预防复发禁忌、无生育要求且年龄较大者)。
(7)宫腔镜子宫内膜息肉去除术的潜在并发症:最常见的并发症为术中子宫穿孔、术后宫腔粘连;宫腔粘连严重影响生育力,对于需要生育者应重视宫腔粘连的预防。
临床上应对子宫内膜息肉进行长期管理,以降低复发及恶变的风险,及时识别恶变的高危因素(年龄>60岁、绝经状态、肥胖、糖尿病、高血压、使用他莫昔芬)[3]。
1. 有生育要求患者的术后管理:如有生育需求且有息肉发生高危因素(表1)的患者,除了纠正可逆的高危因素(如:控制体重和血糖等)之外,建议息肉去除术后尽快妊娠,同时可采用后半周期孕激素治疗控制复发。
2. 暂无生育要求患者的术后管理:对暂无生育要求者,建议术后采用药物长期管理以预防复发,尤其是合并息肉发生高危因素者。可选药物包括左炔诺孕酮宫内缓释系统(LNG‑IUS)、COC、口服孕激素等,应从药物对预防复发的有效性、长期应用的安全性、及患者的用药依从性等方面综合考虑,进行个体化选择。与地屈孕酮或COC相比,宫腔镜子宫内膜息肉去除术后放置LNG‑IUS的患者术后复发率更低[15‑17]。
(1)LNG‑IUS:适用于已完成生育或近期无生育要求的子宫内膜息肉患者。对于无恶变高危因素的患者,如果宫腔镜下见息肉形态似水滴、表面光滑、无增生粗大异形的血管、无腺体开口、无明显子宫内膜异常等特征,在充分沟通并知情同意的情况下,告知放置LNG‑IUS相关的并发症后,可考虑在宫腔镜子宫内膜息肉去除术中即刻放置LNG‑IUS,能避免二次手术操作,且术后复发率及不良反应发生率低[14,18‑19];或者术后明确病理性质后,放置LNG‑IUS可预防复发。
(2)COC:适用于育龄期短期内无生育要求的患者。
(3)后半周期孕激素治疗:具体见上述“药物治疗”;适用于育龄期有生育要求的患者,或围绝经期患者及COC禁忌者。
(4)全周期孕激素治疗:适用于子宫内膜厚且息肉多发,或反复复发者。用法:月经第5天开始,或者术后立即开始,每天口服黄体酮胶囊200 mg、每天1次;或地屈孕酮10 mg,每天2次。建议仅连续用药3~6个月,并采用超声随访治疗效果(包括子宫内膜的厚度)。
(5)子宫内膜去除术后放置LNG‑IUS:无生育要求、反复复发的子宫内膜息肉患者也可采用子宫内膜去除术,推荐术中同时放置LNG‑IUS。
(6)子宫切除术:对于无生育要求、息肉反复复发、无随访条件或有恶变高危因素等患者,可酌情选择子宫切除术。
3. 随访管理:根据患者的月经状况及生育要求每3~6 个月随访,随访内容主要包括症状和超声检查。
4. 乳腺癌内分泌辅助治疗妇女子宫内膜息肉术后的管理:乳腺癌患者的随访具体参照《乳腺癌内分泌辅助治疗相关子宫内膜病变管理指南(2021年版)》[20],患者乳腺癌内分泌治疗前应先筛查,一旦发现子宫内膜息肉,应先予以去除。用药过程中定期筛查,发现子宫内膜息肉可行宫腔镜子宫内膜息肉去除术,术后根据病理结果予相应处理。
对患者进行良好的健康教育可增强患者对疾病的认识,减少患者对手术的恐惧,提高治疗效果和依从性,并有助于预防和减少复发。
就诊时的宣教主要是疾病知识的教育,帮助患者识别和去除可能导致子宫内膜息肉的相关高危因素、常见治疗方案的选择和特点。对于有手术指征的患者需进行术前宣教,包括宫腔镜手术相关知识、术前准备和注意事项、术后预防复发管理的必要性及药物选择。
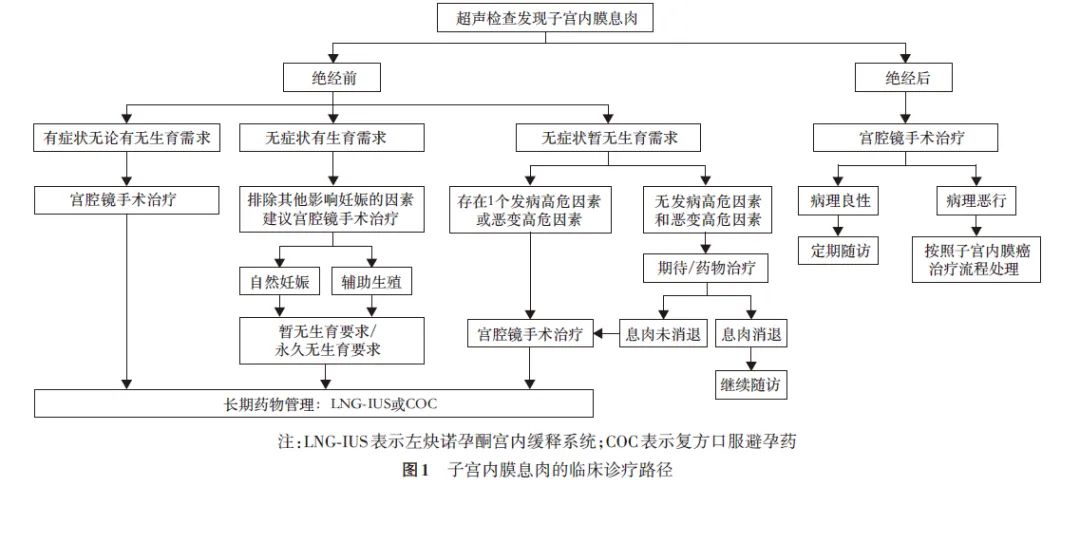
子宫内膜息肉的临床诊疗路径见图1。
文章出处:中华妇产科杂志2022年7月第57卷第7期 《子宫内膜息肉临床诊疗路径》
专家简介

潘宏信
南方科技大学医院妇科副主任
磁波刀治疗中心副主任
南山区盆底宫内疾病防治区域学科联盟副盟主
副主任医师 副教授
医学博士
南方科技大学医学院副教授
安徽理工大学医学院兼职副教授
汕头大学医学院硕士同等学力导师
美国腹腔镜内镜外科医师协会(SLS)国际代表
世界内镜医师协会妇科协会理事
中国妇幼保健协会宫内疾病专委会委员
中国抗癌协会肿瘤标志专业委员会妇科肿瘤标志物专家学组常务委员
广东省卫生经济学会医共体分会妇产科专委会常务委员
熟练掌握腹腔镜、宫腔镜等妇科微创操作技术;掌握妇科常见病、宫腔病变、女性生殖道发育异常的诊治。获2017年COGI大会“青年科学家奖”,获2020、2017年SLS(美国腹腔镜机器人外科医师协会)最佳壁报奖,获2017、2016年SLS(美国腹腔镜内镜外科医师协会)优秀论文。曾赴美国哈佛大学附属波士顿儿童医院、德国图宾根大学附属妇产医院、以色列特拉维夫大学附属医院、奥地利维也纳大学总医院等进行学术访问。以第一作者或通讯作者在American Journal Of Human Genetics,Fertility And Sterility等一流国际期刊发表论文多篇。