2022 CSCO胃癌指南更新要点
首先,根据胃癌Biomarker(HER2、dMMR/MSI-H、PD-L1)进行治疗方案推荐或限定。
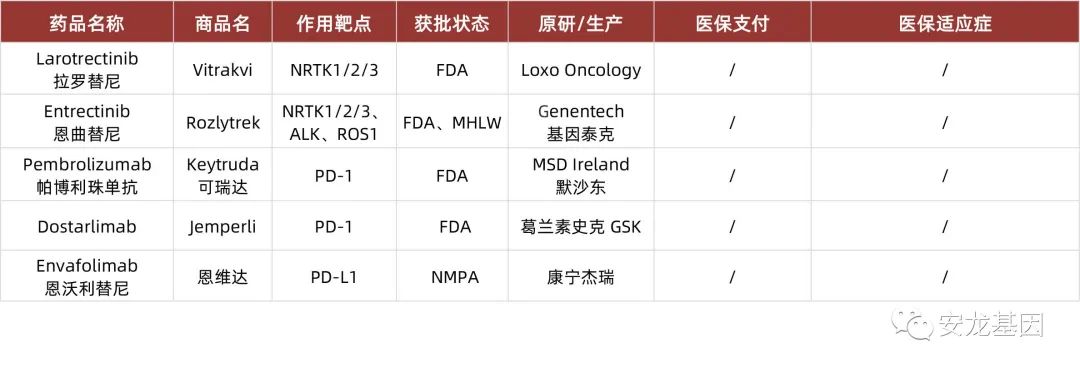
MSI-H/dMMR
既往只是较为含糊地推荐MSI/dMMR状态检测,但新版指南明确推荐要求所有新诊断胃癌患者都常规进行MSI/dMMR状态的评估(Ⅰ级推荐,1B类证据)。主要是源于Checkmate649在2021年ESMO大会上的亚组人群分析。
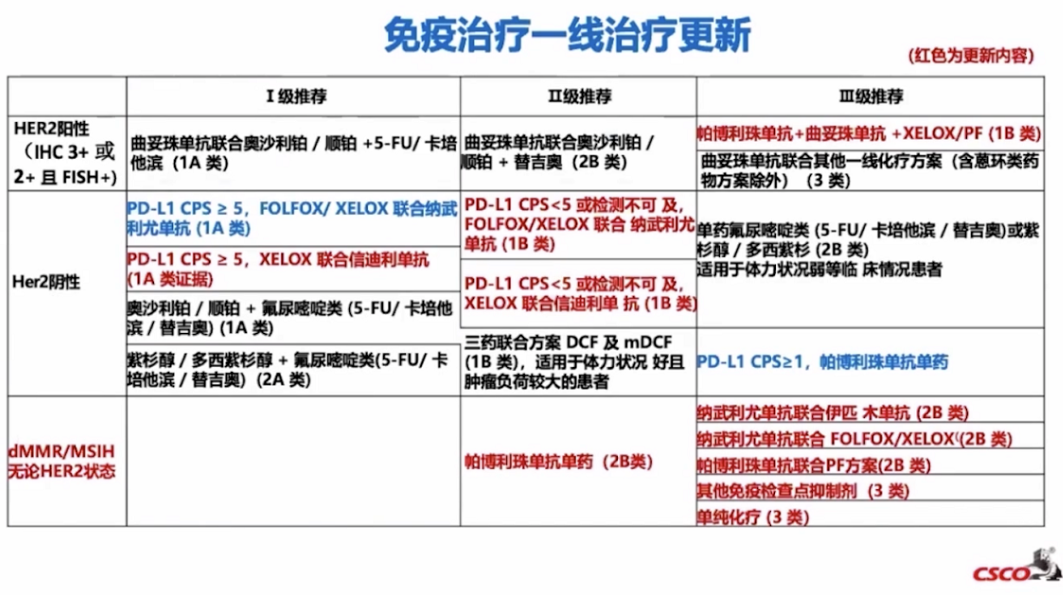
对于HER2阴性PD-L1联合阳性分数(CPS)≥5,一线治疗推荐增加XELOX联合信迪利单抗,IA类证据和I级推荐。
新增HER2阳性胃癌人群一线免疫治疗推荐,帕博利珠单抗+曲妥珠单抗+XELOX/PF方案IB类证据和III级推荐。

晚期胃癌二线更新中,雷莫西尤单抗今年将在国内获批上市,在晚期胃癌二线取得阳性结果的靶向药物,只有雷莫西尤单抗,推荐自然是情理之中。其次,值得注意的是,dMMR/MSI-H晚期转移性胃癌患者二线治疗选择中有两种免疫检查点抑制剂均为我国自主研发药物-恩沃利单抗(2A,I级推荐)、斯鲁利单抗。以dMMR/MSI-H为Biomarker的泛癌种适应症的竞争加剧。
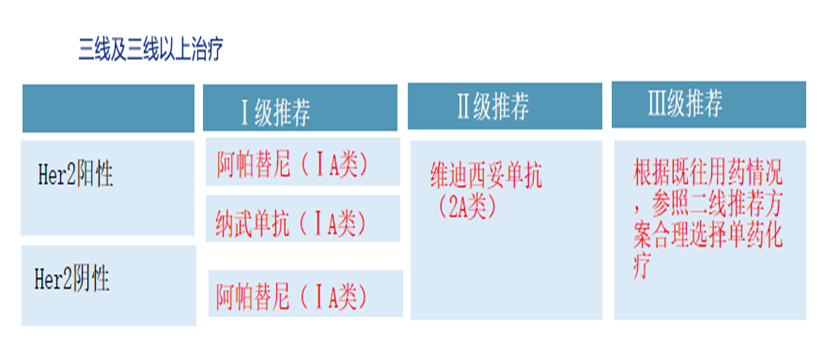
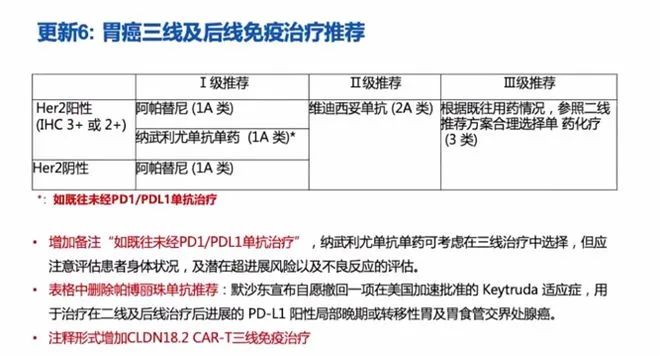
三线及后线免疫治疗的更新主要是对备注的完善以及将撤回FDA适应症的PD-1单抗(帕博利珠单抗)从表格中删除。其次,对于HER2阳性晚期转移性胃癌三线及后线治疗,表格和注释中都分别新增了靶向HER2的ADC药物(维迪西妥单抗)。此外,注释形式增加了Claudin18.2 CAR-T方案。胃癌,这个Biomarker尚不统一。各国指南和共识都有差异的,又因为高度异质性和区域治疗特点,在诊断和治疗中,自然有很多值得探讨的地方。随着免疫和ADC药物的进展,虽然坎坷,却已然改写胃癌一线及后线的治疗格局。期待未来有更多可及的方案在临床上应用。
ATTRACTION-2研究奠定了胃癌三线免疫治疗的地位,CheckMate 649、ATTRACTION-4、KEYNOTE-811等研究则完成了胃癌免疫治疗的一线开拓,目前,胃癌免疫治疗已经形成了三线标准、二线探索、一线新标杆的格局;更有多项研究挺进胃癌新辅助/辅助治疗。从后线到前线,胃癌的免疫治疗在不同方案,不同临床场景,不同人群的尝试中逐步向前。
新辅助/辅助治疗
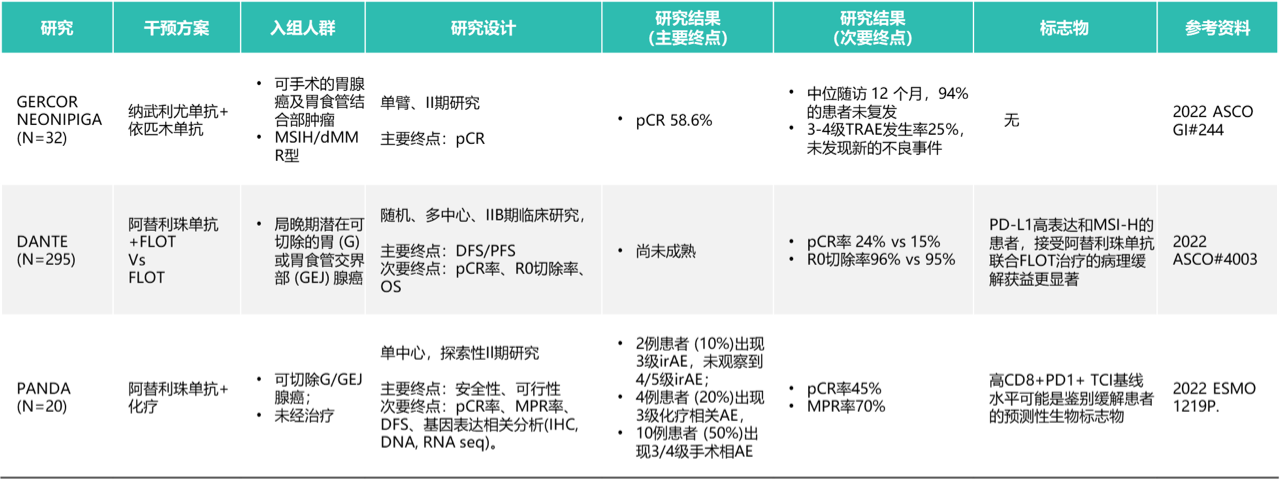
Checkmate-649中国亚组数据
基于CheckMate-649这一迄今为止规模最大的胃癌免疫治疗III期研究,纳武利尤单抗(NIVO)+化疗于2021年获批成为全球和中国首个胃癌一线免疫疗法。2022年ESMO GI大会上,CheckMate-649中国亚组2年随访结果公布,再次引发了胃癌免疫治疗的热议。研究共纳入2000多名既往未经治疗、不可切除的晚期转移性胃癌、胃食管连接部癌(GEJ)及食管腺癌患者。其中中国患者208例,有156例(约占75%)的患者PD-L1 CPS≥5。试验组接受NIVO联合化疗治疗,对照组接受单纯化疗治疗。研究的主要终点是PD-L1 CPS≥5的患者的总生存期(OS)和无进展生存期(PFS)。次要终点包括PD-L1 CPS≥1和≥10的患者的OS、PFS,所有随机人群的PFS,以及客观缓解率(ORR)。研究结果:在PD-L1 CPS≥5的患者中,NIVO联合化疗组与单纯化疗组相比,中位OS分别为15.9个月 vs 9.6个月,中位OS延长将近半年。此外,两年OS率翻倍,由15%提升至39%。在所有随机人群中,NIVO联合化疗组与单纯化疗组相比,中位OS获益同样达到4个月,分别为14.3个月 vs 10.3个月。在PD-L1 CPS≥5人群中,两组中位PFS分别为8.5个月 vs 4.3个月,接近翻倍,疾病进展风险降低49%。在所有随机人群中,中位PFS分别为8.3个月 vs 5.6个月,与在PD-L1 CPS≥5人群中PFS获益的绝对值相当。
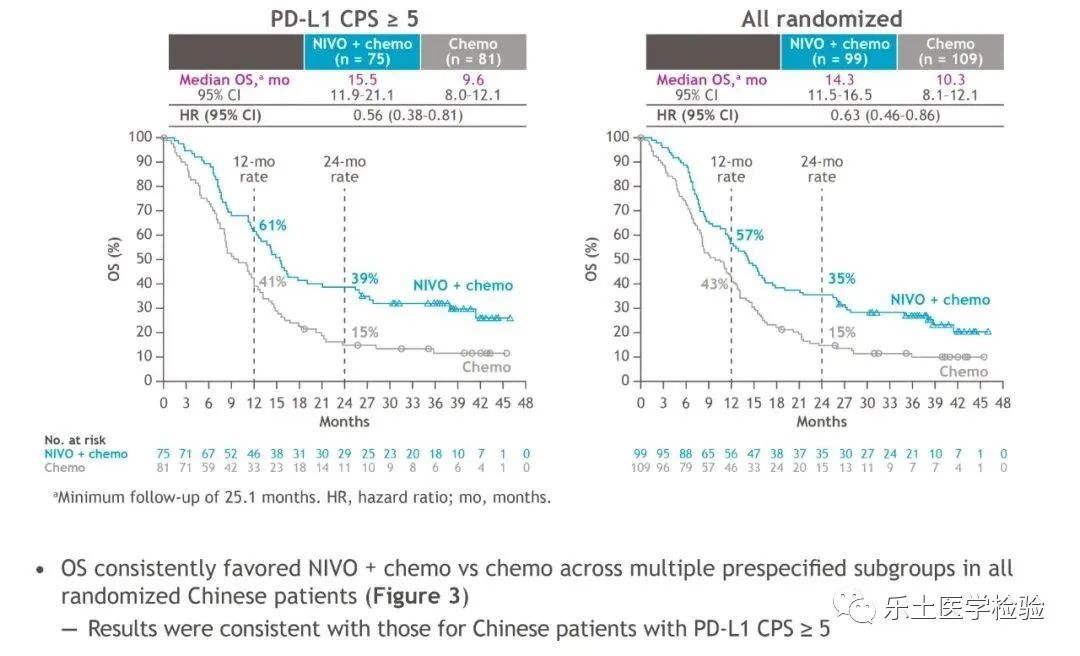
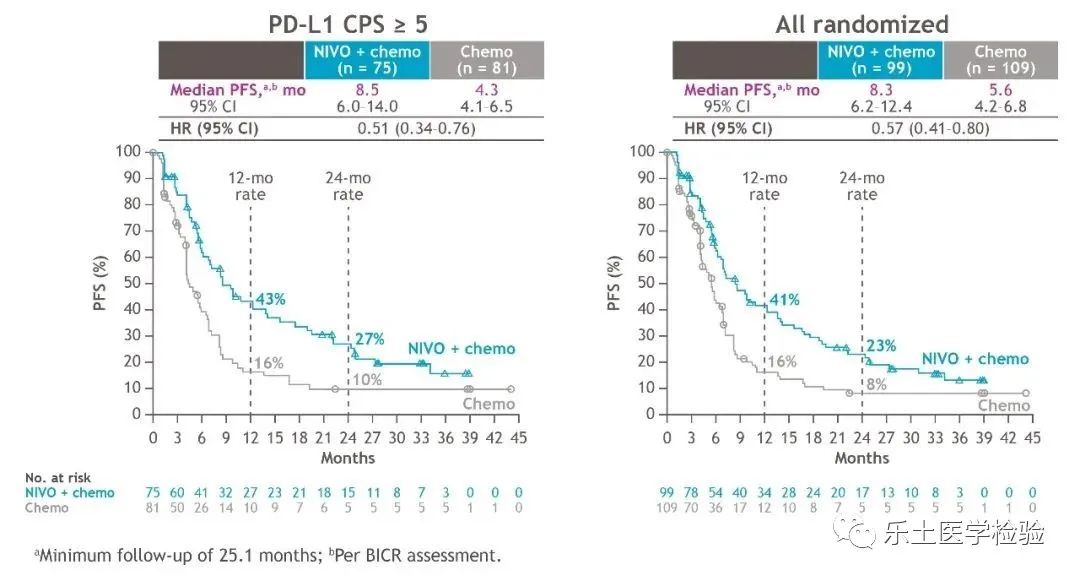
两年随访数据显示,在PD-L1 CPS≥5人群中,使用NIVO联合化疗治疗,将ORR从48%提升到68%,在所有随机人群中,将ORR从45%提升至66%。经过两年长期随访,NIVO联合化疗未发现新的安全信号,绝大多数TRAE为1-2级。研究结论:一线NIVO联合化疗给中国晚期胃癌和GEJ患者带来显著OS改善、更高ORR和更持久反应,并且安全性良好。该随访结果进一步支持NIVO联合化疗作为中国晚期胃癌患者的一线标准治疗。
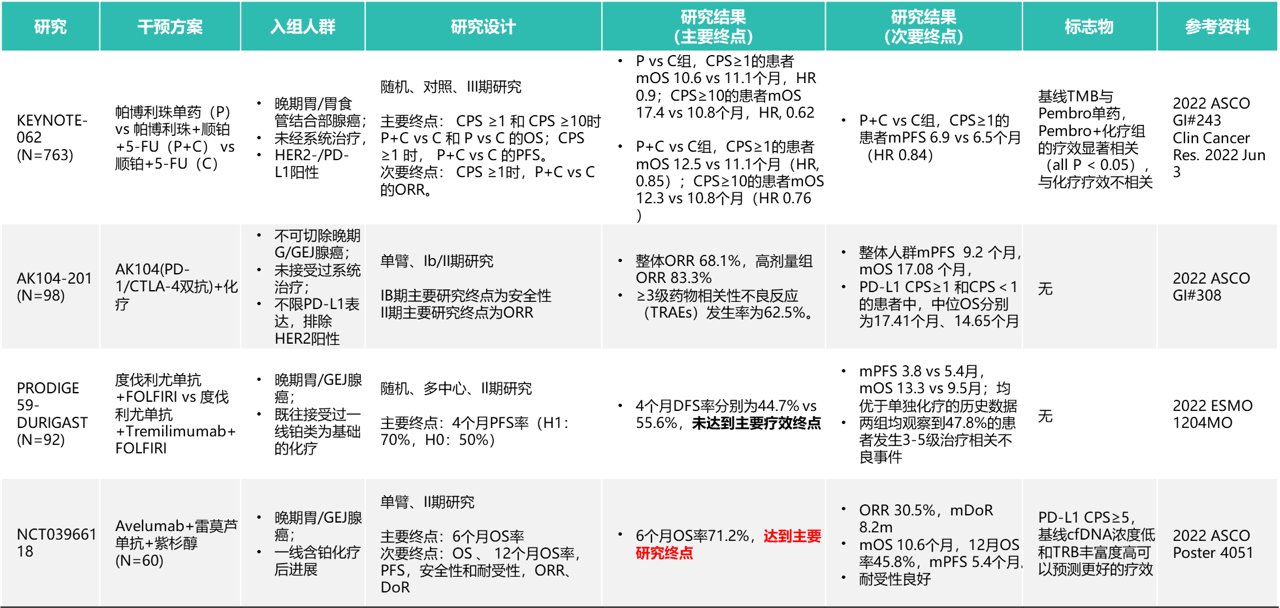
KEYNOTE-811研究:
KEYNOTE-811研究是一项随机、双盲、安慰剂对照的III期研究,该研究纳入692例患者,1:1随机分配到帕博利珠单抗+曲妥珠单抗+化疗组和安慰剂+曲妥珠单抗+化疗组。针对264例疗效评估患者进行的中期分析结果显示,帕博利珠单抗组的ORR为74.4%[完全缓解(CR)率为11.3%,部分缓解(PR)率为63.2%],安慰剂组为51.9%(CR率为3.1%,PR率为48.9%)(单侧p值<0.0001,有统计学意义)。接受帕博利珠单抗治疗的患者中位DoR为10.6个月,安慰剂组为9.5个月,DoR≥6个月的患者比例分别为65%和53%。
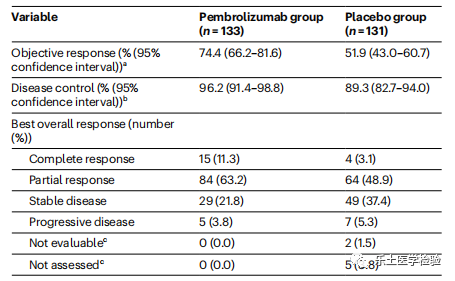
不良反应方面,两组患者3-5级不良反应发生率均为57%,约5%接受帕博利珠单抗治疗的患者出现自身免疫性肠炎、肺炎、甲状腺炎等免疫相关不良事件。研究结论:帕博利珠单抗联合曲妥珠单抗和化疗可以显著提升HER-2阳性晚期胃癌患者的ORR,2022年NCCN指南将该治疗方案作为其他推荐用于HER2阳性晚期胃癌患者的一线治疗。
DANTE/FLOT8研究:
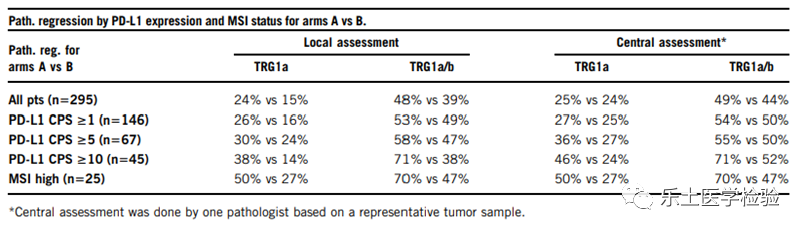
DANTE是一项多中心的IIb期试验,可切除胃和GEJ腺癌(≥cT2和/或N +)患者随机分成2组,接受4+4个周期的围手术期治疗。A组患者接受FLOT化疗方案联合阿替利珠单抗治疗4个周期后进行手术,术后FLOT联合阿替利珠单抗维持治疗4个周期,随后给予阿替利珠单抗单药巩固治疗8个周期。B组患者接受FLOT方案4个周期后进行手术,术后FLOT化疗方案维持治疗4个周期。主要研究终点是PFS和无病生存期(DFS),次要研究终点为pCR/pSR、TRGla/b、R0切除率、pTNM,未转为III期的患者总生存期和安全性。研究结果:295例患者被随机分组(A组:146;B组:149),93%的患者完成了术前FLOT治疗周期,43%的患者完成了术后治疗周期,两组之间没有差异。25例患者(8.5%)为MSI-H;50%的患者PD-L1 CPS≥1,23%的患者PD-L1 CPS≥5,15%的患者PD-L1 CPS≥10。A组与B组进行手术患者的R0切除率类似(96% vs. 95%)。A组的病理缓解优于B组(pT0,23% vs. 15%;pN0,69% vs. 54%)。阿替利珠单抗联合FLOT在病理分期及病理缓解方面获益明显,特别是在MSI-H或者PD-L1 CPS≥5、CPS≥10的人群中获得了更好的疗效。研究结论:在FLOT化疗方案基础上加上阿替利珠单抗,有利于G/GEJ患者的分期降级;同时,对于PD-L1高表达和MSI-H的患者,阿替利珠单抗联合FLOT使患者的病理缓解获益更显著。
NCT03950271研究:
在这项正在进行的单臂II期研究中,从河南省肿瘤医院招募了经组织病理学诊断可切除的HER2阳性胃或GEJ腺癌患者,这些患者临床分期为T3/N+或更高。患者给予4个周期的曲妥珠单抗(负荷剂量为8mg/kg,后续剂量为6mg/kg, q3w)和CAPOX(奥沙利铂130 mg/m2 day1,卡培他滨1000 mg/m2 bid po day1-14,q3w)联合3个周期的卡瑞利珠单抗(200mg, iv, d1, q3w),随后进行手术和4个术后周期的CAPOX。主要终点为病理完全缓解(pCR),次要终点包括主要病理缓解(MPR)和ORR。研究结果:在2020年1月20日至2021年9月15日期间,22名患者入组并开始治疗。4例患者未完成新辅助治疗,两名患者拒绝手术。16例患者行D2切除术,9例(56.3%)实现MPR,其中5例(31.3%)实现pCR (ypT0N0M0),R0切除率为100%,ORR为77.3%。主要的3级或4级治疗相关不良事件(TRAE)包括淋巴细胞减少(22.7%)、中性粒细胞减少(13.6%)、血小板减少(13.6%)和贫血(5%)。最常见的1、2级TRAE为恶心(68.2%)、淋巴细胞减少(63.6%)、白细胞减少(59.1%)、贫血(59.1%)、血小板减少(50%)、血清天冬氨酸转氨酶升高(45.5%)和甲状腺功能减退(31.8%)。无手术延迟或与药物毒性相关的意外手术并发症。研究结论:卡瑞利珠单抗联合曲妥珠单抗和CAPOX新辅助治疗HER2阳性胃或GEJ腺癌是一种安全有效的治疗选择。
DESTINY-Gastric02研究:
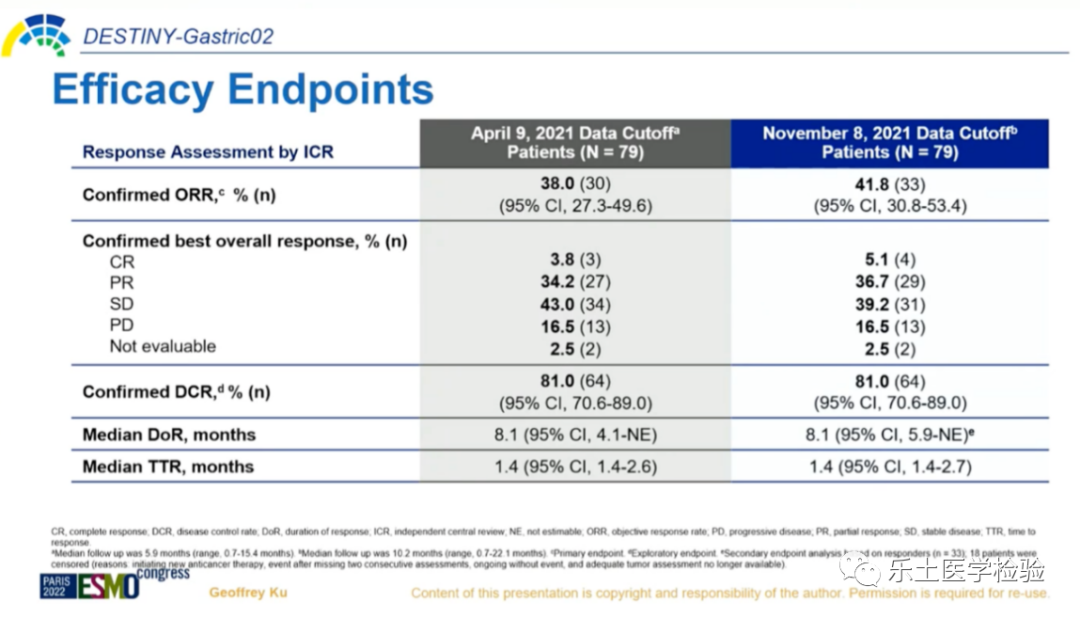
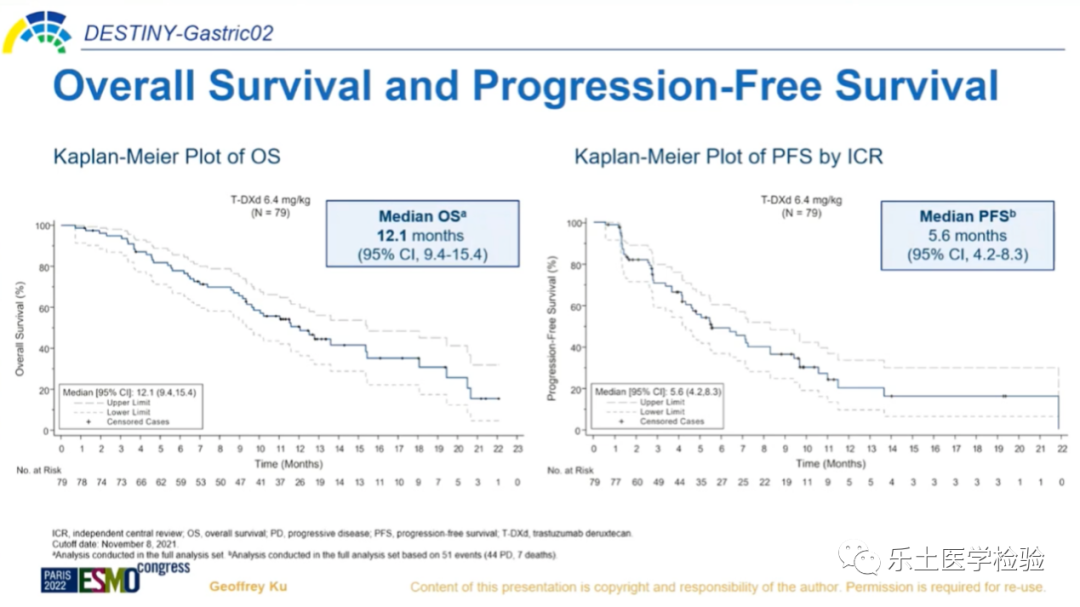
DESTINY-Gastric02是一项开放标签、多中心II期临床研究,研究对象主要的纳入标准包括:不可切除或转移性胃癌或GEJ癌;经过包含曲妥珠单抗治疗后出现疾病进展,且组织学检查明确为HER2阳性(定义为IHC 3+或IHC 2+/ ISH+)。共纳入79名患者,给予T-DXd 6.4 mg/kg Q3W治疗。主要研究终点为独立中心评估(ICR)的ORR;次要终点包括:PFS、OS、缓解持续时间(DoR)、安全性,以及患者报告结局。研究结果:有效性方面,明确的ORR为41.8%(33/79),其中CR为5.1%(4/79),PR为36.7%(29/79),SD为39.2%(31/79),明确的疾病控制率(DCR)为81.0%(64/79),中位DoR为8.1个月,中位应答时间(TTR)为1.4个月。截止目前,中位OS为12.1个月,中位PFS为5.6个月。安全性方面,中位治疗持续时间为4.3个月。任何级别药物相关TEAEs发生率为94.9%(75/79),≥3级药物相关TEAEs发生率为30.4%(24/79),最常见的TEAEs为恶心(67.1%)、呕吐(44.3%)和疲劳(41.8%)。研究结论:总体来说,T-DXd显示出持续的临床获益以及可接受的安全性。
ASTRUM-010研究:
ASTRUM-010是一项国内多中心、开放标签、关键性Ⅱ期研究,共入组108例标准治疗失败的不可切除或转移性dMMR/MSI-H恶性实体瘤(包括胃癌)患者,主要终点为ORR。研究结果:58例敏感性疗效分析人群的ORR为43.1%,12个月总生存率为82.4%,有效性和持续性均令人鼓舞。其中胃癌队列(均接受过二线治疗)疗效获益与整体人群一致。从转化治疗的角度,斯鲁利单抗可观的总体ORR水平也为更多患者带来了接受外科手术治疗的机会,有望获得更大程度的生存获益。ASTRUM-010研究中,斯鲁利单抗总体安全性和耐受性也可管理、可控制,总人群中3级及以上的不良事件发生率仅为27.8%,导致药物治疗终止的不良事件发生率仅为5.6%,具有可靠的临床实践推广应用基础。研究结论:基于ASTRUM-010研究,斯鲁利单抗成为首款获批的国产PD-1单抗,用于单药治疗经标准治疗失败后、不可切除、转移性高度微卫星不稳定型(MSI-H)实体瘤。
胃癌
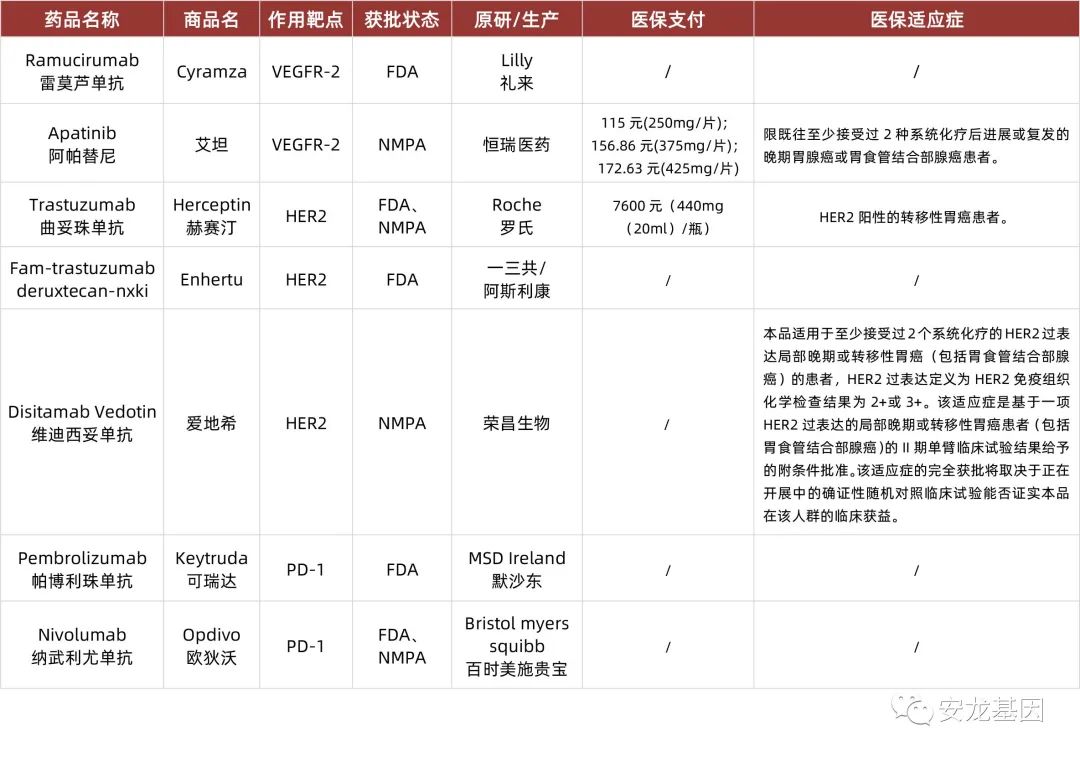
泛肿瘤靶向、免疫药物