
概述
再生障碍性贫血(aplastic anemia,AA),简称再障,是一种可能由不同病因和机制引起的骨髓造血功能衰竭症。基本机制是骨髓不能造血由于骨髓不能造血,所以外周血象三系减少。它是个良性疾病,那么理解这个机制,很多特点大家都可以给推导出来。AA年发病率在我国为0.74/10万,可发生于各年龄组,AA高发年龄分别为15~25岁的青壮年和65~69岁的老年人,男、女发病率无明显差异。AA分为先天性及获得性。目前认为T淋巴细胞异常活化、功能亢进造成骨髓损伤在原发性获得性AA发病机制中占主要地位,新近研究显示辅助性T细胞亚群Th1/Th2分化偏移、调节性T细胞(Treg)及NK细胞调节功能不足、Th17、树突状细胞(DC细胞)以及巨噬细胞等功能异常甚至某些遗传背景都参与了AA发病。先天性AA较为罕见,主要为范可尼贫血(FA)、先天性角化不良(DKC)、先天性纯红细胞再生障碍(DBA)、Shwachmann-Diamond综合征(SDS)等。绝大多数AA属获得性。
临床表现
主要表现为骨髓造血功能低下、全血细胞减少及所致的贫血、出血、感染综合征。
(一)重型再生障碍性贫血(SAA)起病急,进展快,病情重;少数可由非重型进展而来。
1.贫血 多呈进行性加重,苍白、乏力、头晕、心悸和气短等症状明显。
2.感染 多数病人有发热,体温在39℃以上,个别病人自发病到死亡均处于难以控制的高热之中。以呼吸道感染最常见,感染菌种以革兰阴性杆菌、金黄色葡萄球菌和真菌为主,常合并败血症。
3.出血 均有不同程度的皮肤、黏膜及内脏出血。皮肤表现为出血点或大片瘀斑,口腔黏膜有血疱,有鼻出血、牙龈出血、眼结膜出血等。深部脏器出血时可见呕血、咯血、便血、血尿、阴道出血、眼底出血和颅内出血,后者常危及病人的生命。
(二)非重型再生障碍性贫血(NSAA)起病和进展较缓慢,病情较重型轻。
1.贫血 慢性过程,常见苍白、乏力、头晕、心悸、活动后气短等。输血后症状改善,但不持久。
2.感染 高热比重型少见,感染相对易控制,很少持续1周以上。上呼吸道感染常见,其次为牙龈炎、支气管炎、扁桃体炎,而肺炎、败血症等重症感染少见。常见感染菌种为革兰阴性杆菌和各类球菌
3.出血 出血倾向较轻,以皮肤、黏膜出血为主,内脏出血少见。多表现为皮肤出血点、牙龈出血,女性病人有阴道出血。出血较易控制。久治无效者可发生颅内出血。
诊断AA的实验室检测项目
1.推荐检测项目:
①血常规检查:白细胞计数及分类、红细胞计数及形态、HGB水平、网织红细胞百分比和绝对值、血小板计数和形态。
②不同平面多部位骨髓穿刺:至少包括髂骨和胸骨。骨髓涂片分析:造血细胞增生程度;粒、红、淋巴系细胞形态和各阶段百分比;巨核细胞数目和形态;小粒造血细胞面积;是否有异常细胞等。
③骨髓活检:至少取2 cm骨髓组织(髂骨)标本用以评估骨髓增生程度、各系细胞比例、造血组织分布(有无灶性CD34+细胞分布等)情况,以及是否存在骨髓浸润、骨髓纤维化等。
④流式细胞术检测骨髓CD34+细胞数量、阵发性睡眠性血红蛋白尿症(PNH)克隆(CD55、CD59、Flaer)。
⑤肝、肾、甲状腺功能,病毒学[包括肝炎病毒、EB病毒(EBV)、巨细胞病毒(CMV)、细小病毒B19等]及免疫球蛋白、补体、免疫固定电泳检查。
⑥血清铁蛋白、叶酸和维生素B12水平。
⑦免疫相关指标检测:T细胞亚群(如CD4+、CD8+、Th1、Th2、Treg等)、细胞因子(如IFN-γ、IL-4、IL-10等)、NK细胞亚群、自身抗体和风湿抗体,大颗粒淋巴细胞白血病相关标志检测。
⑧细胞遗传学:常规染色体核型分析、荧光原位杂交[del(7)、del(7q-)、+8、del(5q)、del(20q)等]以及遗传性疾病筛查(儿童或有家族史者推荐做染色体断裂试验),胎儿血红蛋白检测。
⑨其他:心电图、腹部超声、超声心动图及其他影像学检查(如胸部X线或CT等)等。
2.建议检测项目:
有条件的医院可开展以下项目:
①骨髓造血细胞膜自身抗体检测;
②端粒长度及端粒酶活性检测、端粒酶基因突变检测;
③二代测序(NGS)检测有无先天性骨髓衰竭性疾病相关基因突变及克隆造血分子标志。
AA诊断标准
1.血常规检查:
全血细胞(包括网织红细胞)减少,淋巴细胞比例增高。至少符合以下三项中两项:HGB<100 g/L;PLT<50×109/L;中性粒细胞绝对值(ANC)<1.5×109/L。
2.骨髓穿刺:
多部位(不同平面)骨髓增生减低或重度减低;小粒空虚,非造血细胞(淋巴细胞、网状细胞、浆细胞、肥大细胞等)比例增高;巨核细胞明显减少或缺如;红系、粒系细胞均明显减少。
3.骨髓活检(髂骨):
全切片增生减低,造血组织减少,非造血细胞增多,网硬蛋白不增加,无异常细胞。
4.除外检查:
必须除外先天性和其他获得性、继发性BMF。
AA治疗原则
SAA一经确诊应尽早启动本病治疗,研究显示SAA诊断30 d内启动治疗疗效明显优于30 d后启动治疗组。确诊为SAA患者及TD-NSAA的标准疗法:对年龄≤40岁且有HLA相合同胞供者的SAA患者,如无活动性感染和出血,首选HLA相合同胞供者造血干细胞移植(MSD-HSCT)。对无HLA相合同胞供者和年龄>40岁的患者首选免疫抑制治疗(IST)[抗胸腺/淋巴细胞球蛋白(ATG/ALG)+环孢素A(CsA)]联合促血小板生成素受体激动剂(TPO-RA)和(或)其他促造血的治疗方案;HLA相合无关供者造血干细胞移植(MUD-HSCT)或单倍体造血干细胞移植(Haplo-HSCT)目前提倡适用于IST无效的年轻SAA患者。对NTD-NSAA可采用CsA联合TPO-RA和(或)其他促造血治疗。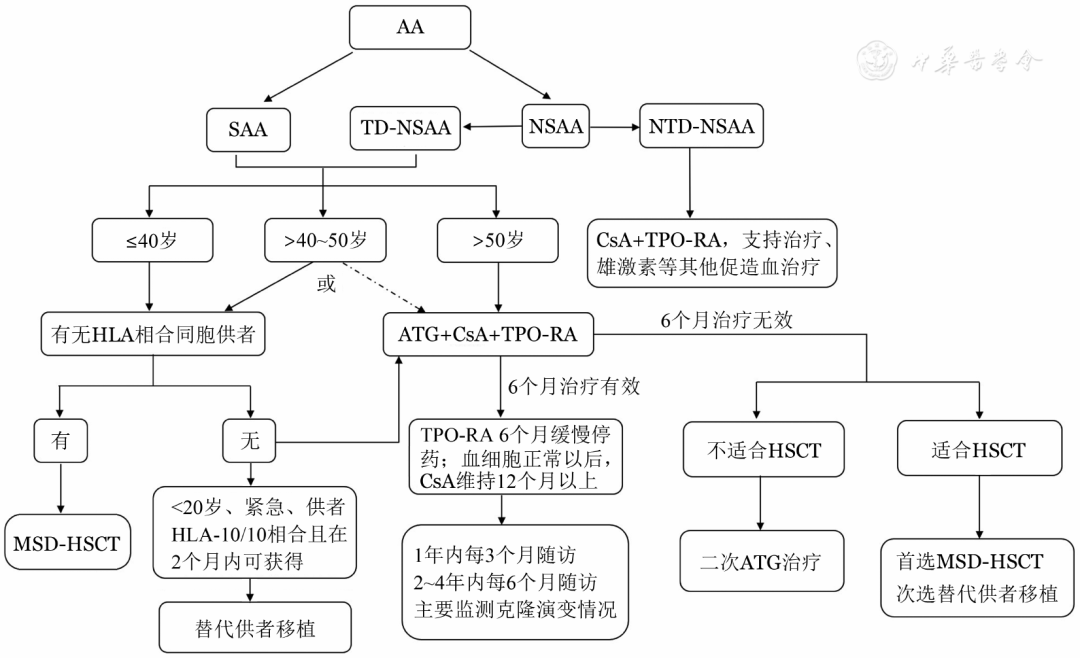 在一线治疗选择时,除了关注年龄、是否存在合并症、疾病的严重程度、造血干细胞移植合并症指数评分(HCT-CI)外,还需评价是否存在影响预后的其他因素。如存在多个IST预后良好因素,则更倾向于一线使用IST联合TPO-RA治疗;如存在多项IST预后不良因素,如端粒显著缩短、不良基因突变(ASXL1、TP53、RUNX1、DNMT3A)、合并难以控制的活动性感染、从NSAA逐渐发展到SAA等,若条件允许尽量选择HSCT,TPO-RA联合IST选择需权衡利弊。无论如何,在TPO-RA联合IST疗效明显提升背景下,选择MUD-HSCT或Haplo-HSCT时,应充分衡量患者风险与获益。
在一线治疗选择时,除了关注年龄、是否存在合并症、疾病的严重程度、造血干细胞移植合并症指数评分(HCT-CI)外,还需评价是否存在影响预后的其他因素。如存在多个IST预后良好因素,则更倾向于一线使用IST联合TPO-RA治疗;如存在多项IST预后不良因素,如端粒显著缩短、不良基因突变(ASXL1、TP53、RUNX1、DNMT3A)、合并难以控制的活动性感染、从NSAA逐渐发展到SAA等,若条件允许尽量选择HSCT,TPO-RA联合IST选择需权衡利弊。无论如何,在TPO-RA联合IST疗效明显提升背景下,选择MUD-HSCT或Haplo-HSCT时,应充分衡量患者风险与获益。
随访
接受IST联合TPO-RA方案治疗的SAA患者应定期随访,以便及时评价疗效和不良反应。主要监测指标包括:①造血功能:血常规(带有网织红细胞绝对值)、骨髓检测(骨髓增生程度、形态学、流式细胞术检测细胞分群变化);②免疫指标:T、B、NK及DC细胞各亚群数量及功能;③克隆演变:染色体、FISH、PNH克隆,MDS/急性髓系白血病(AML)二代测序、端粒长度;④用药不良反应:肝肾功能、电解质、血糖等。建议随访观察点为ATG/ALG用药后3个月、6个月、9个月、1年、1.5年、2年、2.5年、3年、3.5年、4年、5年、10年。