
补充外源性酮体可能有很好的血管保护作用,但长期的生酮饮食可能是有害的。
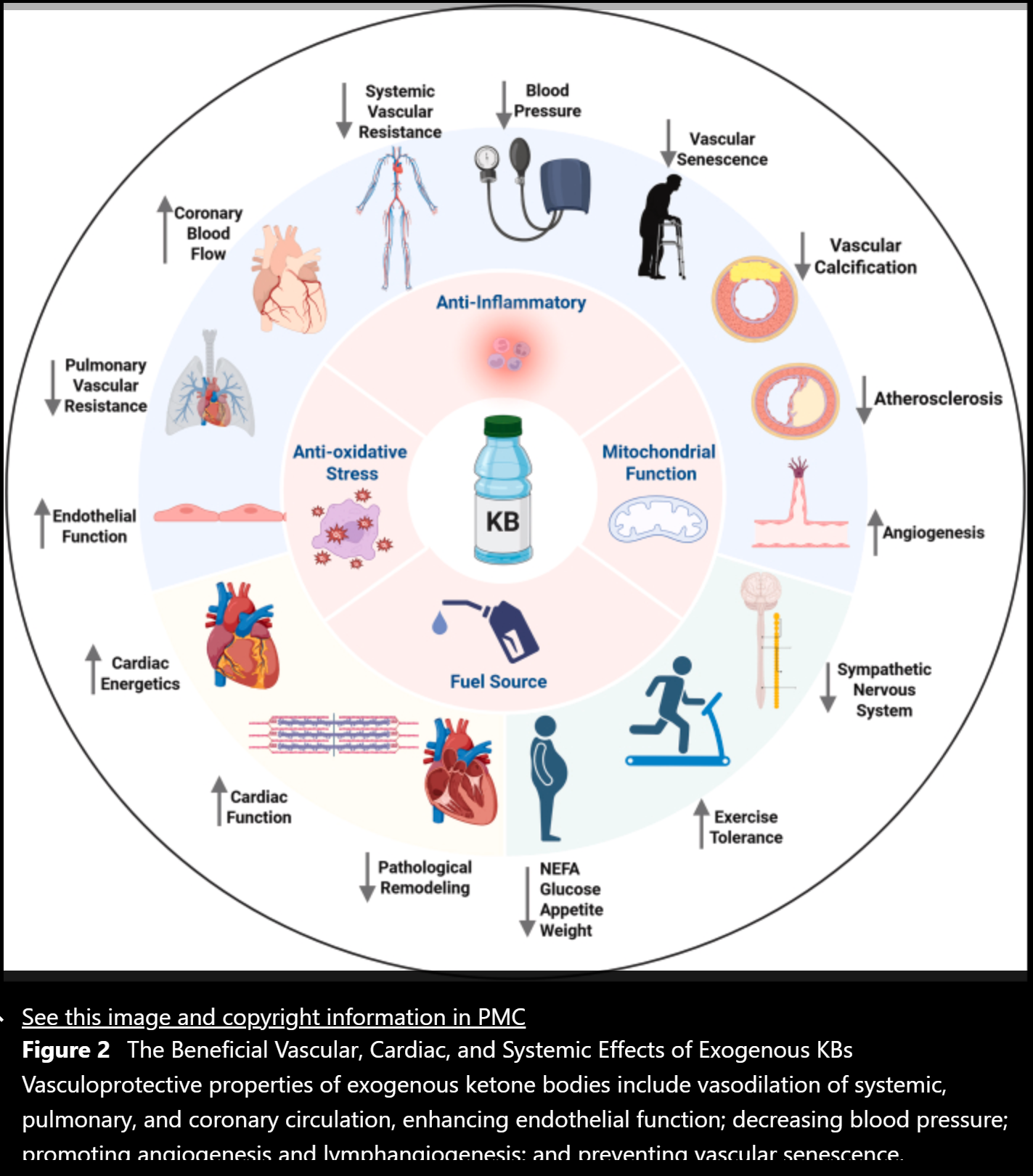
外源性酮体的血管保护作用包括扩张全身、肺循环和冠状动脉循环,增强内皮功能;降低血压;促进血管生成和淋巴管生成;防止血管衰老、钙化和动脉粥样硬化。KBs对心脏的影响包括改善心脏能量,改善病理性重构和增强心功能。KBs的全身代谢作用包括降低葡萄糖和非酯化脂肪酸(NEFA)水平,抑制食欲和体重减轻。KBs还可以提高运动耐受性,抑制交感神经系统。上述活动的细胞机制包括作为燃料来源、抗炎、抗氧化应激和线粒体功能的促进剂。
《JACC: Basic to Translational Science》2025年8月刊的综述文章《Ketone Bodies in Cardiovascular Disease: The Vasculature as a Therapeutic Target》系统梳理了酮体(ketone bodies, KBs)在心血管疾病(CVD)中的治疗潜力,尤其聚焦于血管系统作为其关键作用靶点的新视角。
一、内容与观点
1. 研究背景
– 酮体(β-羟丁酸β-OHB、乙酰乙酸AcAc、丙酮)传统上被视为心肌替代燃料,但近年发现其具有多效性(pleiotropic)作用:抗炎、抗氧化、改善血管内皮功能、促进血管新生等。
– 血管系统是酮体发挥心脏保护作用的关键靶点,但既往研究过度聚焦于心肌能量代谢,忽视血管机制。
2. 核心论点
– 外源性酮体(如酮酯KE、1,3-丁二醇)通过改善血管功能(扩张血管、降低阻力、促进微循环)显著缓解心衰、肺动脉高压、动脉粥样硬化等疾病,其作用独立于能量代谢。
二、酮体对血管系统的具体作用
1. 血管阻力与血流动力学
• 降低全身血管阻力(SVR):临床研究显示,急性输注β-OHB使心衰患者SVR下降5.6 WU,心输出量(CO)增加2 L/min(Nielsen et al., 2019)。
• 扩张冠状动脉:β-OHB增加冠脉血流(CBF)75%(健康人3.8 mmol/L时),但对严重心衰患者效果有限,提示与心肌代谢状态相关。
• 肺血管阻力(PVR):在肺动脉高压(PAH)和慢性血栓栓塞性肺高压(CTEPH)患者中,β-OHB使PVR下降1.3 WU,右心功能改善。
2. 内皮与微血管功能
• 改善内皮依赖性舒张:肥胖患者补充KE 2周后,肱动脉血流介导的舒张(FMD)提升(Walsh et al., 2021)。
• 缓解微血管稀疏:小鼠心梗模型中,β-OHB通过促进VEGF分泌增加梗死周边毛细血管密度(Wang et al., 2025)。
• 骨骼肌氧合:糖尿病患者补充KE后,运动时骨骼肌氧饱和度提高,可能与毛细血管增生相关。
3. 抗动脉粥样硬化与钙化
• 动物实验:β-OHB减少ApoE-/-小鼠主动脉斑块负荷31%,机制涉及抑制NLRP3炎症小体、促进胆固醇外排(Zhang et al., 2021)。
• 抑制血管钙化:在慢性肾病(CKD)大鼠中,1,3-丁二醇通过下调HDAC9/NF-κB信号减少主动脉钙化(Lan et al., 2022)。
4. 淋巴系统
• 促进淋巴管新生:小鼠心梗模型中,β-OHB通过VEGF-C通路增强淋巴引流,减轻水肿(García-Caballero et al., 2023)。
三、分子机制
1. 代谢途径
• 替代燃料:β-OHB经BDH1、SCOT酶氧化为乙酰辅酶A,进入三羧酸循环(TCA),但研究提示其能量效率未必优于传统底物(如脂肪酸)。
• 矛盾现象:L-β-OHB(非代谢活性异构体)仍能显著降低血管阻力,提示非代谢途径更重要。
2. 信号转导与表观遗传调控
• GPR受体:β-OHB通过GPR109A抑制巨噬细胞炎症(抗动脉粥样硬化),通过GPR41抑制交感神经活性(降压)。
• HDAC抑制:β-OHB抑制HDAC3/9,上调抗氧化基因(如SOD2)和紧密连接蛋白(Claudin-5),保护血管内皮。
• β-羟丁酰化(Kbhb):新型组蛋白修饰,调控VEGF、ZO-1等基因表达,促进血管修复(Li et al., 2025)。
3. 抗氧化与抗炎
• 直接清除ROS,抑制NLRP3炎症小体,减少IL-1β、TNF-α释放。
四、临床意义与转化潜力
1. 心衰治疗
– 急性失代偿:单次口服酮酯(25 g)在HFrEF患者中迅速降低SVR和肺毛细血管楔压(PCWP),改善血流动力学(Berg-Hansen et al., 2024)。
– 慢性管理:14天KE治疗使HFpEF合并糖尿病患者运动耐量提高,但峰值摄氧量(VO₂)未显著变化(Gopalasingam et al., 2024),需长期试验验证。
2. 肺动脉高压
– 目前缺乏有效肺血管扩张剂,β-OHB的PVR降低作用(无需侵入性给药)使其成为潜在候选。
3. 代谢综合征
– 改善胰岛素敏感性、减少NEFA释放,间接缓解血管内皮损伤。
五、局限性与未来方向
1. 证据缺口
– 长期安全性:现有试验最长仅4周,需评估慢性高酮血症对肝肾、骨骼的影响。
– DKA风险:糖尿病患者中理论风险,但现有研究未报告(β-OHB水平≤3 mmol/L时安全性良好)。
– 制剂优化:酮酯口感差、胃肠反应高,需开发缓释剂型(如1,3-丁二醇半衰期6小时)。
2. 机制未解问题
– 代谢vs非代谢主导:需利用基因敲除模型(如心肌特异性BDH1缺失)或同位素标记代谢流分析明确贡献比例。
– 组织特异性:心脏、骨骼肌、血管的β-羟丁酰化靶点是否重叠?
六、总结
本文重新定义了酮体在心血管疾病中的作用:从“心肌燃料”转向“血管保护剂”。通过多靶点(血管阻力、内皮功能、微血管密度、炎症)干预,外源性酮体为心衰、肺高压、动脉粥样硬化等提供了超越传统代谢治疗的新范式。尽管仍需大规模长期试验,其血管靶向性和多效性机制使其成为极具前景的辅助治疗策略。