痛风是嘌呤代谢异常导致的一种炎症及免疫性疾病,严重者可导致肾功能不全甚至残疾。近年来随着人们生活水平的提高,痛风的发病率也逐年升高,严重威胁人类健康,给患者家庭和社会带来巨大负担。
目前,临床上最常使用的两类降尿酸药物包括抑制尿酸合成的药物及增加尿酸排泄的药物,然而这些药物都存在一定的副作用。有些痛风患者就算严格控制饮食、坚持药物治疗,仍然会尿酸偏高,那么除了饮食和尿酸排泄因素,是否还有其他导致尿酸高的因素呢?今天咱们就来剖析一下痛风的另一个原因——肠道菌群。
人体主要通过肾脏和肠道两条途径排泄尿酸,约70%的尿酸通过肾脏排出,其余30%随肠道排出或经肠道菌群进一步分解代谢。肠上皮细胞中的尿酸转运体负责将尿酸从血液转运至肠腔,继而尿酸从肠腔直接排出体外或者由肠道菌群分解。经肠道途径排泄尿酸盐减少是高尿酸血症的常见原因。近年来,有学者通过比较痛风患者和健康人肠道菌群组成发现,痛风和高尿酸血症患者体内存在肠道菌群失调,主要表现为条件致病菌的增加和促抗炎症因子产生细菌的减少。痛风和高尿酸血症患者肠道菌群组成与健康人群有明显区别,其中粪便拟杆菌富集,而柔嫩梭杆菌、普氏菌及双歧杆菌缺乏,且痛风患者肠道菌群变化要早于外周血中尿酸的变化。此外,降尿酸治疗后肠道菌群可发生改变。 饮食是影响胃肠道菌群组成的重要因素,高嘌呤饮食、高果糖饮食、高脂饮食等所导致的高尿酸血症动物模型中肠道菌群组成均发生变化。肠道既是尿酸的排泄途径之一,同时也是肠道菌群的生存环境。肠上皮细胞存在尿酸转运子,可以将尿酸从血液中转运到肠腔内,然后进一步排出体外。果糖的摄入增多是痛风和高尿酸血症患病率升高的重要原因。与葡萄糖分解代谢不同,果糖的代谢过程中无限速酶、无负反馈,可消耗大量的三磷酸腺苷(ATP),导致一磷酸腺苷(AMP)大量的产生,一磷酸腺嘌呤核苷脱氨酶活性的增强使其降解成次黄嘌呤、肌醇,最终分解为尿酸,导致血尿酸水平的升高。
西方高果糖饮食可导致肠道菌群中厚壁菌门细菌增加,不利于肠道拟杆菌的生长。研究发现,在高果糖饮食喂养的小鼠中,肠道微生物多样性下降,表现为拟杆菌门比例较低,变形菌门比例明显增加。
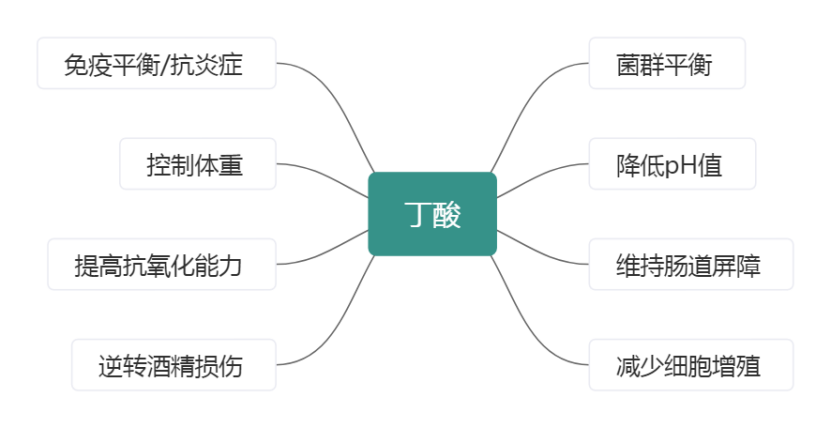
研究发现,高嘌呤饮食导致高尿酸血症的同时,诱导肠道菌群结构发生变化。高嘌呤饮食可导致双歧杆菌和乳杆菌数目减少。以上研究表明,高嘌呤、果糖饮食可能是高尿酸血症、痛风患者肠道菌群失调的原因。痛风患者接受益生菌治疗可有效改善关节炎症状,提示痛风的发病与肠道菌群失衡有关。肠道益生菌的发酵产物丁酸、乳酸可促进Treg 细胞分化,介导免疫耐受,从而达到控制炎症的目的,该机制可能在痛风中发挥作用。而肠道菌群失调可影响Th17 与Treg 细胞的免疫平衡,通过调节肠道菌群可调控Th17 与Treg 细胞的免疫失衡,故改善肠道菌群有可能成为控制痛风反复发作的新方法。双歧杆菌作为一种益生菌,可抑制有害细菌,改善胃肠粘膜屏障功能,并抑制促炎细胞因子释放,同时也可通过增加短链脂肪酸的产生,介导免疫耐受。然而,双歧杆菌在痛风患者肠道中的丰度降低。此外,肠道菌群可影响嘌呤的代谢,如肠道中的乳杆菌,可吸收利用嘌呤,从而减少饮食嘌呤在肠道中的吸收。双歧杆菌和乳杆菌制剂可以降低高尿酸血症小鼠的血清尿酸。某些益生菌制剂在降低高尿酸血症血尿酸的同时,还对血压和肾脏功能产生有益影响。膳食纤维在大肠内通过细菌多糖酶分解能生成短链脂肪酸(如前文提到的丁酸)。短链脂肪酸能刺激黏膜细胞增殖和黏膜血供,对胃肠激素的释放具有促进作用,改善肠道蠕动。短链脂肪酸既能为肠道有益菌的生存提供良好的环境,维持细胞膜的完整性,又是细胞膜合成和脂类合成所需物质的主要来源。丁酸是一种短链脂肪酸,它是人肠道上皮细胞的主要营养物质,人体内超过95%的丁酸在结肠内产生和吸收,一定水平的丁酸能够使结肠细胞保持稳定,从而可防止或抑制癌变,调节肠道菌群失调和治疗肠易激综合征、抗生素相关性肠炎、急慢性腹泻等疾病。丁酸降低肠道pH值,可防止肠道中诸如肠球菌和大肠杆菌等病原性微生物的生长。丁酸对人体这么重要,怎样获取?目前的策略有增加膳食中富纤维食物的摄入,合理补充益生菌和益生元。综上,通过益生菌益生元制剂、粪菌移植来调节肠道菌群、恢复肠道微生态稳态,或许是控制痛风和高尿酸血症的另一个安全手段。痛风和高尿酸血症患者除了控制嘌呤、果糖的摄入,还需养好自己的肠道菌群。相关问题,欢迎来我院营养科咨询。
参考文献:
1.Oral treatment with Bifidobacterium longum 51A reduced inflammation in a murine experimental model of gout. Benef Microbes,2015,6 (6) :799-806.
2.Intestinal microbiota distinguish gout patients from healthy humans. Sci Rep,2016,6: 20602.
3. Probiotics may delay the progression of nonalcoholic fatty liver disease by restoring the gut microbiota
structure and improving intestinal endotoxemia. Sci Rep,2017,7: 45176.
4. Combined signature of the fecal microbiome and metabolome in patients with gout. Front Microbiol,
2017,8: 268.
5.Probiotic supplements prevented oxonic acid-induced hyperuricemia and renal damage. PLoS One,2018,13(8) : e0202901.
6. Chronic fructose intake and metabolic syndrome.Int J Endocrinol Metab,2018,38(5) : 339-342. (in Chinese).
END



编辑:曾瑶池
审核:宣传小组
校对:深圳市中医院营养科