
当我嘱咐肥胖患者少吃点主食时,经常得到的回答是:“我吃得不多,喝水都会胖!”他们显得很无辜。答案可能藏在肠道里——那里住着数以万亿计的微生物,它们不仅能决定你消化食物的效率,还可能悄悄“操控”你的体重!今天,我们就来聊聊肥胖与肠道菌群的“爱恨情仇”,或许可以通过移植健康菌群“逆天改命”。
如果把肠道比作一个生态系统,肥胖患者的肠道菌群就像一场混乱的派对——有害菌狂欢,有益菌被冷落。研究发现,肥胖人群的肠道菌群多样性显著降低,某些“坏菌”比例异常升高,比如脱硫弧菌。这些菌会释放硫化氢,直接抑制肠道L细胞分泌GLP-1(一种控制食欲和血糖的关键激素),导致代谢紊乱和脂肪堆积。
研究显示,肥胖患者存在以下问题:
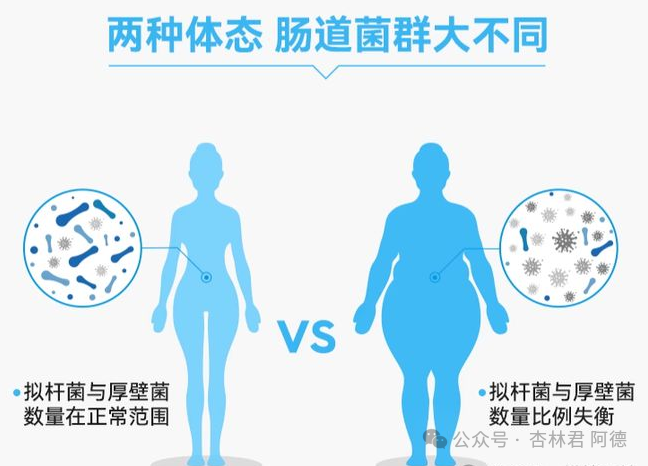
1.菌群多样性下降:肥胖患者的肠道菌群α多样性(物种丰富度)普遍低于健康人群。例如,厚壁菌门中的有益菌如粪杆菌属减少,而变形菌门中的致病菌比例升高。
2.代谢功能异常:肥胖者肠道中短链脂肪酸(SCFAs,如丁酸)的产量显著减少。SCFAs不仅能抑制炎症,还能通过“肠-脑轴”调节饱腹感。若缺乏,身体更容易储存脂肪。
3.双向因果关系:孟德尔随机化研究表明,肠道菌群失调与肥胖互为因果。某些菌群(如毛螺菌科)的丰度增加会直接推高体质指数,而肥胖又会进一步破坏菌群平衡,形成恶性循环。
既然肠道菌群失调是肥胖的“帮凶”,能否通过移植健康菌群来逆转?答案是:有希望,但并非万能!
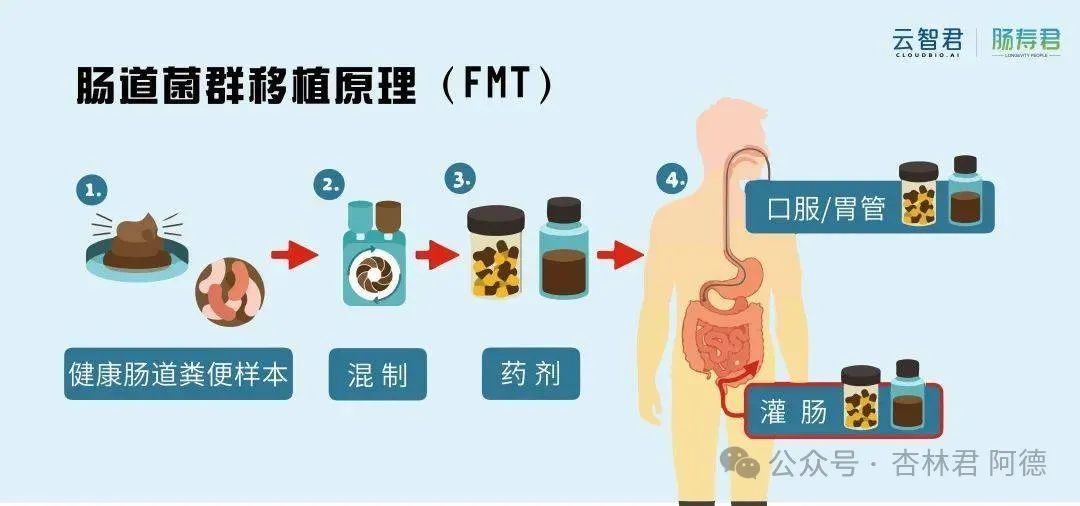
粪菌移植(FMT),即把健康供体的肠道菌群“搬家”到患者肠道内,已被用于治疗艰难梭菌感染等疾病。近年来,科学家开始探索它在肥胖中的潜力。
一项针对严重肥胖患者的2期临床试验发现,FMT联合膳食纤维补充可提高胰岛素敏感性,6周后响应者的胰岛素抵抗指数显著下降。其中,基线时普雷沃氏菌属丰度较高的患者效果更佳。接受FMT后,患者肠道菌群的多样性增加,且特定有益菌(如罗斯氏菌属)的定植与代谢改善密切相关。
当然,移植的效果因人而异!研究发现,受体的饮食(如高纤维摄入)、炎症水平及基线菌群状态会极大影响移植效果。例如,高脂饮食者可能因供体菌群定植失败而疗效不佳。所以,即使移植了好的菌群,也要呵护好才能让他们发挥应有的作用。
有趣的是,一名肝硬化患者在接受FMT治疗后,不仅肝性脑病发作减少,体重还意外增加了8斤。这是因为移植的菌群优化了他的营养吸收能力。
动物实验中,将肥胖人群的菌群移植给小鼠,虽未直接导致肥胖,但改变了肠道代谢物(如吲哚乙酸),提示菌群可能通过间接途径影响代谢。
尽管前景光明,FMT治疗肥胖仍面临三大挑战:
1.粪菌移植的供体的筛选非常严苛:健康供体需“千里挑一”,需无代谢疾病、规律排便,甚至性格开朗(太忧郁可能影响菌群!)。
2.效果不持久:部分患者仅在短期内改善,长期仍需结合饮食、运动等干预。
3.机制待破解:菌群如何精准调控代谢?噬菌体、代谢产物(如SCFAs)的作用仍需深入探索。

未来我们可能从以下三个方面提高粪菌移植的疗效:
1.个性化治疗:基于患者基线菌群特征预测疗效,定制移植方案。
2.合成菌群胶囊:避开“粪便”直接补充关键菌种,提高安全性和接受度。
3.饮食联合干预:高纤维饮食可增强移植菌群的定植效果,形成“菌群-饮食”协同作用。
肠道菌群不仅是消化助手,更是代谢的“隐形操盘手”。虽然粪菌移植尚未成为减肥“神药”,但它为对抗肥胖提供了全新视角——未来,我们或许能通过“菌群银行”存储健康微生物,随时为身体按下“重启键”。当然,均衡饮食、规律作息仍是守护菌群平衡的第一道防线。毕竟,再高科技的移植,也抵不过你每天对肠道的百般呵护!
(图片源于网络,如涉及版权,请联系作者删图)