
2025 ASCO GU
2月13日-15日
2025年美国临床肿瘤学会泌尿生殖系统肿瘤研讨会(ASCO-GU)于当地时间2月13日-15日在美国旧金山隆重召开。大会汇聚来自全球的学者和专业人士,旨在分享和探讨泌尿生殖系统肿瘤领域的最新研究成果,包括前列腺癌、膀胱癌、肾癌和睾丸癌等泌尿生殖系统肿瘤的最新进展。
本次大会中,EV-302/KEYNOTE-A39研究公布了12个月额外随访的最新数据,【ONCO前沿】特此整理摘要内容,以飨读者!
研究背景:
EV-302/KEYNOTE-A39(NCT04223856)研究中一线维恩妥尤单抗(Enfortumab Vedotin,EV)+帕博利珠单抗(Pembrolizumab,P)显著改善了局部晚期或转移性尿路上皮癌(la/mUC)患者的无进展生存期(PFS)和总生存期(OS)获益。EV+P是指南推荐针对未经治la/mUC患者的标准治疗方案。研究者对EV-302研究进行了12个月的额外随访(中位随访时间>2年),并对确认完全缓解(cCR)的患者进行了探索性分析。
研究方法:
既往未经治的la/mUC患者按1:1比例随机分配接受EV治疗(1.25mg/kg;第1天和第8天;IV)和P(200mg;第1天;IV)或吉西他滨联合顺铂或卡铂(每3周一次)。双主要终点为盲态独立中心审查委员会(BICR)评估的PFS和OS。选择的次要终点是确认的客观缓解率(cORR)、缓解持续时间(DOR)和安全性。探索性分析评估了cCR患者的治疗结果和安全性。
研究结果:
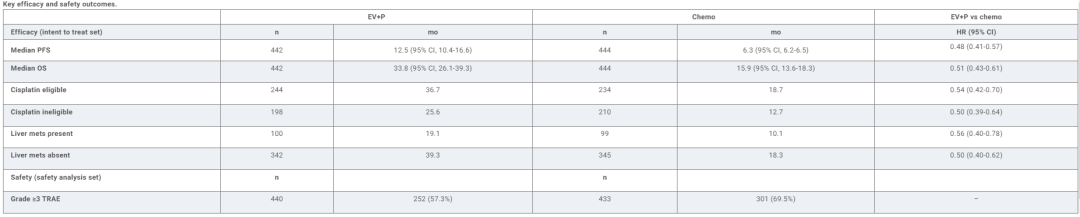
886例患者随机接受EV+P(n=442)或化疗(n=444)。在数据截止日期(2024年8月8日),中位随访时间为29.1个月(95%CI:28.5-29.9)。与化疗组相比,EV+P组经BICR评估的PFS(HR=0.48;95%CI:0.41-0.57)和OS(HR=0.51;95%CI:0.43-0.61)均有改善。
在安全性分析集中,EV+P组与化疗组≥3级治疗相关不良事件(TRAEs)的发生率分别为57.3%和69.5%,cCR亚组分别为61.7%和71.9%。在EV+P组和化疗组的安全性分析中,治疗相关死亡事件的发生率分别为1.1%和0.9%;在cCR亚组中没有发生。
研究结论:
EV+P在广泛人群中继续显示出优于化疗的疗效,与初步分析结果一致。研究结果证实了EV+P的持久疗效,且未发现新的安全性信号,进一步巩固了EV+P作为la/mUC患者的一线标准治疗地位。
参考文献:
Thomas Powles, et al. 2025 ASCO GU, Abstract 664.