
引言
加拿大每年新诊断约13,300例膀胱癌病例,其中约25%在初诊时即为肌层浸润性。肌层浸润性膀胱癌(MIBC)具有侵袭性生物学特性,存在潜在的转移能力。总体而言,诊断为局限性MIBC患者的五年死亡率约为30–50%。转移性膀胱癌患者的长期生存罕见。为规范治疗并优化护理,我们提出MIBC的国家指南。
方法
通过Medline和EMBASE数据库组合检索,系统收集所有与MIBC及局部晚期膀胱癌相关的文献。检索关键词包括:“膀胱癌”“尿路上皮癌”“浸润性”“肌层浸润性”“转移性”。筛选条件为英语文献、人类研究,索引日期范围为2000年至2024年(含)。同时手工检索综述文献的参考文献,以补充遗漏内容。
此外,参考了欧洲泌尿外科协会(EAU)、美国临床肿瘤学会(ASCO)、美国泌尿外科协会(AUA)及美国国家综合癌症网络(NCCN)近期发布的指南,并结合加拿大泌尿生殖系统肿瘤学家协会(GUMOC)的建议。
组建了由具备MIBC及局部晚期膀胱癌诊疗经验的学术型临床专家组成的指导委员会,负责制定指南。针对诊断、经尿道膀胱肿瘤切除术(TURBT)病理评估、分期、治疗、支持与姑息治疗、随访及生活质量(QoL)等领域提出最佳实践建议。最终推荐意见通过专家委员会多轮反馈与共识达成。每个章节均简要讨论了关键问题。
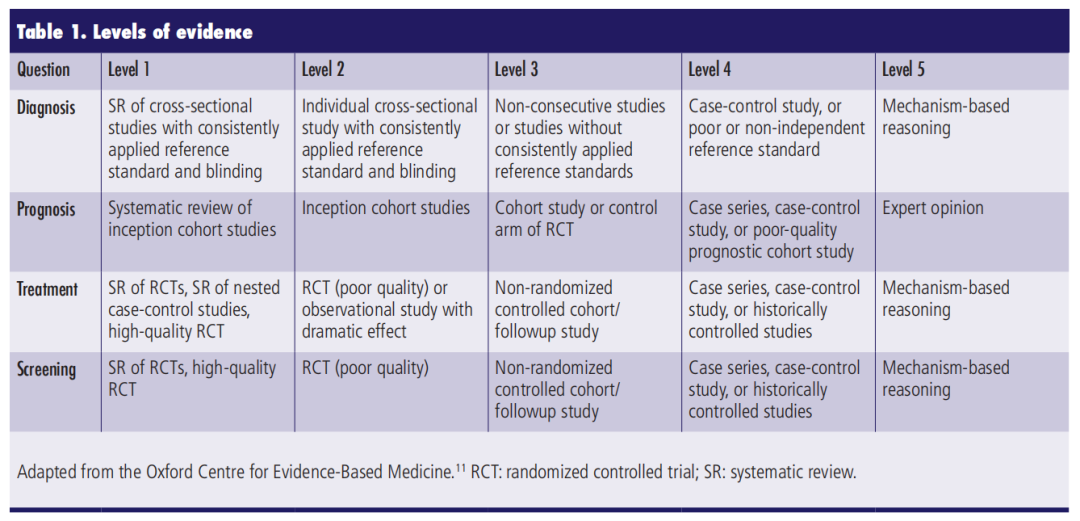
指南建议尽可能基于牛津循证医学中心的分级系统(表1)标注证据等级(LE)。每条建议的主观共识推荐强度(强、中等、弱)根据现有证据的数量、质量及一致性进行判定。若高质量且一致的证据支持某建议,或专家间存在广泛共识且进一步研究不太可能改变对该建议的信心,则标注为“强”推荐。相反,“弱”推荐表示证据水平不足或建议存在显著不确定性。若治疗建议主要基于生物学合理机制而无明确数据支持,则标注为“专家意见”。
CUA将在所有主要指南中采用GRADE方法学。在全面过渡前,指南将沿用原始制定方法更新。本文件中推荐意见的证据等级基于牛津循证医学中心标准或标注为专家意见。
证据综合:指南推荐与讨论
尽可能对MIBC患者进行多学科评估(专家意见)。
所有疑似MIBC患者均需进行全面病史采集和体格检查,以评估膀胱功能、合并症及整体体能状态。膀胱镜检查应作为初始评估的一部分,因其可明确肿瘤位置和病变范围,对所有膀胱癌的初步诊断至关重要。
▶ 推荐意见2
MIBC的诊断需通过高质量经尿道膀胱肿瘤切除术(TURBT),标本中需包含固有肌层以确认肌层浸润(证据等级3,强推荐)。
局限性膀胱癌的诊断通常始于高质量TURBT。在可能的情况下,建议完全切除所有肉眼可见病灶,以确保最佳病理分析并使患者达到临床无瘤状态,从而保留包括TMT在内的所有治疗选择。然而需注意,对于体积较大的肿瘤,完整经尿道切除可能不安全或无法实现。
若膀胱固有肌层取材不足,通常无法确诊MIBC。在此类情况下,应强烈考虑再次切除;但极少数情况下,若影像学或临床证据(如双合诊检查)明确支持MIBC诊断,且 1)肿瘤体积过大无法安全完成完整TURBT,和/或 2)完整TURBT根本不可行,则仍需获取肿瘤组织以确立膀胱癌诊断并明确最终组织学类型。
应报告肿瘤的组织学类型(如尿路上皮癌、鳞状细胞癌、小细胞癌等)。若肿瘤存在混合组织学类型,需注明样本中每种组织学类型的占比(证据等级3,强推荐)。
需记录其他病理数据,包括浸润深度、分级、伴发原位癌(CIS)及脉管侵犯(LVI)(证据等级3,强推荐)。
需记录尿路上皮癌的异向分化(如伴鳞状或腺样分化)及组织学亚型(如肉瘤样、微乳头状、浆细胞样、巢状亚型等),并估算每种亚型及异向分化的比例(证据等级3,强推荐)。
所有疑似特殊组织学亚型的病例,建议由第二位病理科医师(最好是泌尿生殖系统专科病理医师)进行病理复核(证据等级3,中等推荐)。
尽管尿路上皮癌占MIBC的90%,但腺癌、鳞状细胞癌等非尿路上皮组织学类型需特别关注,因其通常就诊时分期更晚、复发风险更高、预后更差,且对标准治疗反应可能不同。其他已知影响后续治疗和监测决策的不良预后因素包括LVI和CIS的存在。具体而言,伴发CIS与RC术后更高的复发率及pT2或更低分期患者更差的癌症特异性生存(CSS)相关,同时也与放疗抵抗相关。存在LVI的患者疾病侵袭性更强,其记录可能强化新辅助化疗(NAC)的必要性。
尿路上皮癌可能表现为 1)异向分化(如鳞状、腺样、滋养层细胞分化)或 2)组织学亚型(既往称为变异型组织学),包括肉瘤样、微乳头状、浆细胞样、巢状、微囊型、淋巴上皮瘤样、巨细胞型、富脂型、透明细胞(富含糖原)及低分化神经内分泌癌。世界卫生组织将微乳头状、浆细胞样、肉瘤样、神经内分泌及低分化形态学特征归类为侵袭性更强的类型。
鉴于有报道显示微乳头状和浆细胞样亚型的占比与预后不良相关,国际指南建议量化各亚型的比例。由于尿路上皮癌亚型的病理识别存在显著观察者间差异,所有此类组织学类型的肿瘤均需进行病理复核,最好由泌尿生殖系统专科病理医师完成。
建议在TURBT后立即进行麻醉下检查,以准确判断临床分期和可切除性(证据等级3,中等推荐)。
胸部、腹部及盆腔计算机断层扫描(CT)是局限性MIBC和转移性膀胱癌分期的理想影像学手段(证据等级3,中等推荐)。
磁共振成像(MRI)可作为评估局部病变范围的备选方案(证据等级3,中等推荐)。
骨扫描并非必需,但在碱性磷酸酶(ALP)升高、高钙血症或骨痛时应进行(证据等级3,中等推荐)。
目前,正电子发射断层扫描(PET)CT在膀胱癌分期中的作用尚不明确(证据等级4,弱推荐)。
在开始治疗前,必须对临床分期进行准确评估。除了全面的麻醉下检查外,还需进行腹部和盆腔轴向成像(CT或MRI)以排除淋巴结或转移性疾病。这些检查也有助于确定病变的局部范围,这对制定手术或放疗方案是必要的。在肾功能允许的情况下,应进行增强扫描(即CT或MR尿路造影)并获取延迟图像,以评估是否伴发上尿路疾病并排除肾积水。可选方案是,在切除(TURBT)前使用膀胱影像报告与数据系统(VI-RADS)评分进行多参数盆腔MRI检查。
胸部成像(CT优于胸部X光片)也应进行,以排除转移性疾病或伴发肺癌,因为尿路上皮癌患者吸烟率较高,而胸部CT对检测转移灶的敏感性最高。目前,尚无充分证据推荐在膀胱癌患者中常规使用PET-CT成像。
围手术期全身治疗
▶ 推荐意见12
所有符合条件的膀胱尿路上皮癌患者(临床分期cT2-T4aN0M0)应接受肿瘤内科评估,以在根治性膀胱切除术(RC)前接受以顺铂为基础的联合化疗(吉西他滨联合顺铂[GC];或剂量密集型甲氨蝶呤、长春碱、多柔比星及顺铂[dd-MVAC])作为新辅助化疗(NAC)(证据等级1,强推荐)。
▶ 推荐意见13
符合条件的患者,在采用三联疗法(TMT)保留膀胱前,也应考虑使用NAC(证据等级3,强推荐)。
▶ 推荐意见14
对顺铂为基础的NAC存在禁忌症的患者应直接接受根治性局部治疗(证据等级2,强推荐)。
顺铂为基础的NAC的绝对禁忌症包括:东部肿瘤协作组(ECOG)体能状态≥2级、2级听力损失或神经病变、未控制的感染、心力衰竭(NYHA III-IV级)及估算肾小球滤过率(eGFR)≤50ml/min/1.73m²。相对禁忌症包括eGFR 50–60ml/min/1.73m²、反复感染史及合并免疫抑制状态。
▶ 推荐意见15
对于拟接受或符合NAC条件的患者,应通过经皮肾造瘘解除恶性输尿管梗阻以优化肾功能(专家意见)
▶ 推荐意见16
接受GC方案NAC治疗(完成2/4周期)后,应重新评估分期以确认治疗反应或疾病稳定。若出现非转移性进展性疾病或化疗相关严重毒性(无法继续治疗),应停止NAC,并在末次化疗后4–6周内行膀胱切除术。接受dd-MVAC方案(每两周一次)的患者无需在化疗期间再分期,因其疗程较短且无需影像学复查。NAC结束后建议进行CT复查以重新分期(专家意见)。
▶ 推荐意见17
接受NAC的患者应在完成NAC后4–6周内(最长不超过末次化疗后10周)接受膀胱切除术,以避免生存期受损(证据等级3,中等推荐)。
▶ 推荐意见18
纯非尿路上皮癌(鳞状细胞癌、腺癌等)无需NAC,但小细胞癌例外,符合条件的患者应接受新辅助铂类/依托泊苷治疗(证据等级3,强推荐)。
▶ 推荐意见19
对于未在膀胱切除术前接受NAC的患者,若术后病理显示pT3/T4和/或pN1-3疾病,应向符合条件的患者提供以顺铂为基础的辅助联合化疗(GC或dd-MVAC)(证据等级1,强推荐)。
▶ 推荐意见20
对接受根治性切除术且复发风险高的患者(pT3/4或pN1-3疾病,或新辅助治疗后ypT2-4/ypN1-3疾病),应提供纳武利尤单抗辅助免疫治疗(证据等级1,强推荐)。
在这项首次纳入GC方案的NAC随机试验中,化疗可选择新辅助或辅助模式,但大多数患者(88%)接受了新辅助治疗。尽管无统计学意义,dd-MVAC组五年总生存(OS)率数值上高于GC组(64% vs. 56%,风险比[HR] 0.77,95%置信区间[CI] 0.58–1.03,p=0.078)。预设亚组分析显示,新辅助亚组的疾病特异性生存(DSS)(五年率:72% vs. 59%,HR 0.63,95%CI 0.46–0.86,p=0.004)和OS(五年率:66% vs. 57%,HR 0.71,95%CI 0.52–0.97,p=0.032)具有统计学意义,支持 dd-MVAC方案。
尽管有1级证据支持NAC,但直到最近其使用率仍较低,部分研究表明依从性仅为34%。推测采纳率低的潜在原因包括:对延迟确定性治疗的担忧、NAC期间静脉血栓栓塞(VTE)风险、NAC相关死亡风险,以及NAC的非选择性(即缺乏识别最可能从NAC中获益患者的手段)。然而,支持NAC的随机试验已通过设计控制了化疗诱导的静脉血栓栓塞(NAC组发生率更高,风险比[RR]3.39,95%CI 1.39–8.24)、化疗直接导致的死亡,以及NAC导致的根治性治疗延迟。
即使存在上述潜在不足,一项评估NAC的荟萃分析仍显示了生存获益。多项报告还表明,NAC不会增加围手术期发病率或并发症发生率,进一步支持其使用。NAC完成后需充足时间(至少2-3周)恢复全血细胞计数参数并优化患者身体状态,然后再进行根治性治疗。NAC后根治性治疗的理想时机为4-6周内,最长不超过10周以避免影响预后。
总体证据质量更支持NAC作为围手术期化疗的首选方案,因许多辅助化疗(AC)试验存在入组不足、提前终止及统计效力不足的问题。此外,约24–52%的RC术后患者因肾功能恶化无法接受AC(具体比例取决于入选标准),术后并发症也可能限制AC应用(约30%符合条件的患者因此无法治疗)。鉴于转移性疾病是MIBC患者最常见的致死原因,应采用能最大限度实施多模式治疗的策略,故优先选择NAC。
对于膀胱切除术后存在高危疾病特征的患者,应考虑辅助免疫治疗。
Checkmate 274试验(一项对比纳武利尤单抗与安慰剂用于pT3/4或N1-3疾病[或新辅助治疗后ypT2-4/ypN1-3疾病]的随机对照研究)显示,纳武利尤单抗组所有患者的无病生存期(DFS)均改善。在意向治疗(ITT)人群中,纳武利尤单抗组的中位DFS(主要终点)为20.8个月(95%CI 16.5–27.6),安慰剂组为10.8个月(95%CI 8.3–13.9);6个月无病生存率分别为74.9% vs. 60.3%(疾病复发或死亡HR 0.70,98.22%CI 0.55–0.90,p<0.001)。
中期OS数据显示,ITT人群中纳武利尤单抗组OS优于安慰剂组(HR 0.76,95%CI 0.61–0.96),肿瘤PD-L1>1%人群OS获益更显著(HR 0.56,95%CI 0.36–0.86)。ITT人群纳武利尤单抗组中位OS为69.5个月,安慰剂组为50.1个月。亚组分析提示,既往接受NAC的患者DFS改善更明显。
类似地,AMBASSADOR试验显示,帕博利珠单抗(pe mbrolizumab)辅助治疗可改善高危膀胱切除术患者的DFS。该试验在纳入人群(与Checkmate 274相似,但包含镜下切缘阳性患者)中对比帕博利珠单抗与观察。帕博利珠单抗组中位DFS为29.6个月(95%CI 20.0–40.7),观察组为14.2个月(95%CI 11.0–20.2)(HR 0.73,95%CI 0.59–0.90,p=0.003)。该试验的双主要终点为DFS与OS,两组OS无差异(死亡HR 0.98,95%CI 0.76–1.26),但因达到DFS终点被视为阳性结果。截至本指南撰写时,纳武利尤单抗是加拿大唯一获批并纳入医保用于高危MIBC的辅助治疗方案。
对于未接受NAC的高危患者(即pT3/4或pN1-3),建议咨询肿瘤内科以评估AC或辅助免疫治疗的适用性,通常优先考虑AC。但最终选择AC或辅助免疫治疗需由肿瘤内科医生与患者共同决策,因目前尚无头对头试验比较辅助化疗与免疫治疗的疗效。