
Bhat, K.R.S., Yadav, S., Kind, S., Punnen, S., Kumar, A. (2022). Prostate Cancer Screening and Biopsy. In: Wiklund, P., Mottrie, A., Gundeti, M.S., Patel, V. (eds) Robotic Urologic Surgery. Springer, Cham. https://doi.org/10.1007/978-3-031-00363-9_11
一、引言 前列腺癌是美国最常见的癌症,也是癌症相关死亡的第二大常见原因。目前,前列腺癌的筛查通常包括临床直肠指检(DRE)和血清前列腺特异性抗原(PSA)检测。尽管近年来成像技术的进步有助于更精准地识别和定位潜在恶性病变,但确诊和分级仍依赖活检。二、前列腺癌筛查 在泌尿外科领域,前列腺癌的常规筛查颇具争议。由于其癌症特异性生存率相对较高,人们对是否应常规筛查存疑。目前,最具争议的问题是前列腺癌的过度诊断,以及难以识别未来可能发展为临床显著癌症的低级别前列腺癌。1. 直肠指检:当怀疑前列腺癌时,建议进行全面的直肠指检,这是标准筛查的一部分,也是大多数指南所推荐的。直肠指检的敏感性、特异性和阳性预测值分别为81%、40%和42%。异常的直肠指检结果通常提示病情更具侵袭性,可能为高容量前列腺癌。对美国队列的二次分析显示,异常的直肠指检和异常的PSA水平与临床显著前列腺癌(csPCa)和前列腺癌特异性死亡率独立相关。2. 前列腺特异性抗原:1991年,William Catalona 博士首次提出使用PSA进行前列腺癌筛查。PSA和直肠指检是最常用的筛查工具。虽然医生普遍将血清PSA阈值设定为4 ng/ml 来决定是否进行前列腺活检,但约15%的恶性肿瘤发生在该阈值以下。为了更好地对患者进行风险分层,人们研究了许多基于PSA的衍生指标和复杂计算方法,如游离PSA与总PSA比值(F/T比值)、PSA密度(PSAD)、PSA速率(PSAV)、复合PSA(cPSA)等。值得注意的是,PSAD在决定患者是否需要活检方面越来越常用。传统上,0.15 ng/ml³ 被用作预测临床显著前列腺癌的阈值,但许多报告建议降低该值,尤其是在前列腺较小的患者中,当PSAD低于0.15 ng/ml³ 时也应考虑活检。3. 游离与总比值:PSA有游离和复合两种形式。前列腺癌细胞产生的PSA主要是复合形式,与血清蛋白如α1抗胰凝乳蛋白酶、α2巨球蛋白和α1蛋白酶抑制剂结合。F/T比值低于25%可能提示恶性肿瘤,可避免约20%的不必要前列腺活检。近期研究表明,F/T比值低于15%可能具有更高的预测准确性。4. 前列腺癌抗原3:前列腺癌抗原3(PCA3)是一种在前列腺癌患者中高度表达的基因。越来越多使用尿液中PCA3的检测来评估前列腺癌。当阈值设定为35时,尿PCA3的敏感性和特异性分别为62%和75%。携带BRCA突变的患者即使没有前列腺癌,尿液中的PCA3也可能升高。5. 4K检测:4K检测是通过结合血清中的总PSA、游离PSA、完整PSA和人激肽释放酶2(tPSA、fPSA、iPSA和hk2)的值,以及直肠指检、既往活检和年龄等因素,构建列线图来预测前列腺癌的概率。4K检测可以预测侵袭性特征,如癌灶超出腺体、肿瘤体积>0.5 cm³ 或任何 Gleason 评分≥4的前列腺癌。其受试者工作特征曲线下面积(AUC)>0.80。在7.5%的阈值下,4K检测可减少30 - 58%的活检数量,仅在1.3 - 4.7%的患者中漏诊临床显著前列腺癌。总体而言,PSA联合直肠指检常用于前列腺癌筛查,但最大的问题是确定活检的PSA阈值。前列腺癌甚至可能在PSA低至0.1 ng/ml时就已存在。在这方面,PSAD最为有用。F/T PSA比值可能为PSA检测增加一定价值,但在当前的生物标志物和MRI检测背景下,其附加价值有限。PSAV被证明会增加阴性或惰性活检的数量。合理使用这些PSA衍生指标和如4K检测等新方法,有助于预测临床显著前列腺癌。目前有许多风险计算器,利用这些检测来预测临床显著前列腺癌,但在临床上尚未广泛应用。三、前列腺癌活检自20世纪初以来,前列腺活检一直是临床实践的一部分。1926年首次采用开放会阴技术进行前列腺活检,但因其侵入性和高发病率未被广泛接受。1930年,该技术改进为经会阴针吸或穿刺活检,但因获取组织量少、诊断潜力有限而被放弃。1937年,手指引导的经直肠前列腺活检成为标准方法,并沿用了50年。1974年,渡边等人首次通过经直肠超声对前列腺成像,20世纪80年代可连接活检针导向器的出现,使得经直肠超声引导下的前列腺活检成为可能。1. 经直肠超声引导下前列腺活检:多年来,超声成像技术和活检技术的不断进步,使经直肠超声引导下前列腺活检成为诊断前列腺癌的首选方法。在经直肠超声上,恶性前列腺病变的表现可以是低回声、等回声或高回声,但均无特异性。 - 术前准备:决定活检后,必须排除严重凝血功能障碍、严重免疫抑制和急性前列腺炎等活检禁忌证。应向患者告知手术的风险和益处,并说明可能的并发症。 - 前列腺活检与抗凝:需全面审查患者的所有用药,重点关注抗凝/抗血小板治疗,如阿司匹林、华法林、氯吡格雷,以及新型口服抗凝剂,如达比加群、利伐沙班和阿哌沙班。必须评估使用抗凝剂/抗血小板药物的潜在原因和血栓事件的风险。与治疗干预医生/心脏病专家进行详细咨询,有助于评估长期使用抗凝剂/抗血小板药物患者的风险 - 获益比,采取个体化治疗方案。对于血栓风险低的患者,可考虑停用抗凝剂/抗血小板药物;而高血栓风险患者则需进行桥接治疗。对于血栓风险低的患者,停用抗凝剂/抗血小板药物可安全进行,不会增加出血并发症的风险。通常做法是在活检前5天停用阿司匹林,7 - 10天停用华法林和氯吡格雷,活检后12 - 24小时即可恢复使用,以平衡出血和血栓形成的风险。大量证据表明,接受前列腺活检的患者可安全继续使用低剂量阿司匹林,不会增加中度或重度血尿、直肠出血或血精的风险。不过,服用阿司匹林的患者发生轻度血尿的可能性是停药患者的1.36倍,且血尿持续时间更长。虽然有有限证据表明,高血栓风险患者在服用华法林且国际标准化比值(INR)维持在2 - 3的治疗范围内时,可进行前列腺活检,但在临床实践中,大多数高血栓风险患者会使用普通肝素或低分子肝素进行桥接治疗。对于活检后出血严重的患者,最好改用肝素,因为这些新型口服抗凝剂均不可逆转。对于肾功能异常的患者也需谨慎,因为这些药物主要通过肾脏清除,可能需要更长的等待时间才能安全进行前列腺活检。 - 抗生素预防:感染性并发症是活检后住院的最常见原因,且在过去几年呈上升趋势。近期的系统评价和荟萃分析发现,抗生素预防可将感染性并发症的风险显著降低至5.6%,而随机分配至安慰剂或未接受抗生素预防的患者为11.6%(相对风险0.56)。与其他下尿路手术不同,无论风险因素如何,所有接受前列腺活检的患者均建议进行抗菌预防。传统上,氟喹诺酮类药物是该情况下的首选预防性抗生素,但过度使用和滥用导致氟喹诺酮耐药性增加,一些欧洲国家已暂停其作为预防性抗生素的使用。美国食品药品监督管理局(FDA)也限制了氟喹诺酮类药物的使用,因其可能导致长期的关节功能障碍。此外,氟喹诺酮耐药性的广泛传播,使得使用氟喹诺酮后的再入院率与未使用抗生素相似,表明广泛使用氟喹诺酮导致了抗生素耐药性的增加。因此,基于直肠拭子培养结果,使用碳青霉烯类/多种抗生素联合或其他抗生素进行前列腺活检的情况越来越多。美国泌尿协会(AUA)还建议,鉴于氟喹诺酮类药物潜在的严重不良事件,将其预防用药时间缩短至最长24小时。推荐的替代药物包括第一代、第二代或第三代头孢菌素和氨基糖苷类。2014年AUA更新指南将甲氧苄啶 - 磺胺甲恶唑作为预防药物,2021年欧洲泌尿协会(EAU)指南也根据近期荟萃分析的结果,推荐磷霉素氨丁三醇作为可行的替代药物。另一种应对抗生素耐药导致的感染性并发症的方法是强化预防,即使用多种抗生素联合预防,而非单一抗生素。然而,不加选择地使用多种广谱抗生素必然会导致抗生素耐药性,且违背抗生素管理协议。为克服这些缺点,在接受前列腺活检的患者中评估了靶向预防,即对计划进行前列腺活检的患者进行直肠拭子采样并培养,根据拭子培养的药敏结果给予预防性抗生素。与经验性使用抗生素相比,靶向预防已被证明可减少感染性并发症,并可能预防抗生素耐药性的产生。因此,根据现有证据,基于直肠拭子指导的抗生素进行全程24小时的靶向预防应是首选方法。或者,在氟喹诺酮类药物未获许可的地区,氨基糖苷类、头孢菌素或磷霉素氨丁三醇等抗生素可作为替代方法,使活检更具灵活性,因为拭子指导的方法需要48小时才能获得药敏结果。虽然强化预防有效且被推荐,但它与抗生素管理相悖,且需要了解当地抗菌药物耐药模式的最新情况。 - 减少活检后感染的非抗生素策略:许多机构常规建议患者在活检前在家中自行进行清洁灌肠。虽然这种做法可减少直肠内的粪便量,提供更好的声学窗口以成像前列腺,但并未发现其能降低感染性并发症的发生率。接受清洁灌肠和未接受清洁灌肠的患者,感染性并发症或住院率相似。台上直肠准备可通过将一块纱布浸泡在由15 ml市售10%聚维酮碘溶液与5 ml 1%利多卡因凝胶混合制成的糊剂中,然后插入直肠并放置2分钟,取出后再进行活检。一些作者还主张用浸泡聚维酮碘的纱布擦拭直肠前壁,而非简单插入,以确保均匀涂抹。近期的一项荟萃分析评估了直肠使用聚维酮碘的效果,发现与对照组相比,聚维酮碘组的感染性并发症在统计学上显著降低(聚维酮碘组930名男性中有60例感染,对照组1006名男性中有131例感染,相对风险0.56)。鉴于这些发现,近期指南推荐在经直肠前列腺活检前使用聚维酮碘进行直肠清洁。在活检前1 - 2小时或即将活检前放置直肠聚维酮碘栓剂,已被证明可减少感染性并发症。直肠拭子评估显示,使用聚维酮碘栓剂后,直肠内的菌落形成单位平均减少了99.9%。2. 活检技术 - 设备:经直肠前列腺活检通常使用带有6 - 10 MHz探头的灰阶经直肠超声机。目前大多数中心使用的新型机器可自我编程,以实现对前列腺的最佳成像。它们具有端射和侧射两种模式,可同时在横切面和矢状面观察前列腺。为确保良好的耦合,通常在探头与覆盖的避孕套之间以及避孕套与直肠表面之间涂抹润滑剂或超声凝胶。活检可采用侧射或端射模式。对于侧射配置,将探头向头侧推进可成像前列腺底部,撤回则可成像前列腺尖部。成像侧方需要旋转探头,顺时针旋转可成像前列腺左侧,逆时针旋转可观察右侧叶。对于端射探头,以肛门为支点,将探头向阴囊方向倾斜可成像前列腺底部,向骶骨方向移动可观察前列腺尖部。成像侧方时,将探头向天花板方向抬起可成像前列腺左叶,向地板方向放下可观察右叶。虽然侧射模式更常用,但一些大型回顾性研究发现,采用端射方法活检的患者癌症检出率高于侧射方法。然而,两项关于该主题的随机研究反驳了这一观点,均未发现两种配置在癌症检出率上存在差异。Van der Slot等人指出,端射配置的癌症检出率更高(52.4%对45.6%,p = 0.066),但未达到统计学意义,且两组在前列腺尖部的癌症检出率相似。不过,他们发现端射配置可获得比侧射方法更长的组织芯长度(151 mm对138 mm),这表明端射方法对前列腺的采样更好。除了癌症检测,侧射探头通常外形较小,需要旋转和进出运动,因此与端射探头相比,可能引起的疼痛较小,端射探头尖端较大,需要在肛门括约肌处进行支点运动。然而,现在大多数探头都集成了两种模式,这些因素可能不再起作用。 - 患者体位与前列腺成像:患者取左侧卧位,斜躺在手术台上,臀部位于台边。膝盖和臀部弯曲90度,膝盖间放置一个枕头以保持体位。将臀部置于台边或略超出台边,可使超声探头自由无障碍地移动。偶尔,可能需要采用右侧卧位或截石位。患者需排空膀胱,进行术区准备和铺巾。然后检查肛周皮肤有无肛裂或其他异常,并进行直肠指检以评估前列腺结节。将带有活检导向器并覆盖润滑良好避孕套的超声探头轻轻插入直肠,对前列腺进行成像。前列腺成像从底部开始,向尖部进行。扫描外周区是否存在任何低回声或高回声病变,这些病变可能提示恶性肿瘤。直肠指检摸到的任何结节也需用超声检查。然后使用椭圆、球体或长球体公式计算前列腺体积。 - 麻醉:前列腺活检通常在局部麻醉下进行,可采用盆腔神经丛阻滞(PPB)或前列腺周围神经阻滞(PNB),并通常辅以直肠内局部麻醉(ILRA)和前列腺内局部麻醉(IPLA),可联合或不联合口服镇痛药。虽然PNB联合镇静镇痛或低剂量脊髓麻醉可能是缓解前列腺活检相关疼痛的最有效方法,但医疗成本的潜在增加和相关额外风险限制了其使用。单纯直肠内注入局部麻醉凝胶的镇痛效果不如局部前列腺阻滞,已不再推荐。局部麻醉注射可使用22G、25 cm的千叶针,注入5 ml 2%利多卡因,前列腺两侧各2.5 ml,可采用盆腔神经丛阻滞(PPB)或前列腺周围神经阻滞(PNB)。对于PPB,直接将麻醉剂注入位于精囊尖端两侧的盆腔神经血管束。由于这些神经束在灰阶超声上不可见,因此在矢状面纵向扫描中可视化精囊尖端后,激活彩色多普勒模式以识别微小血管,然后将麻醉剂注入盆腔神经血管丛,注射前务必回抽以避免血管内注射。对于PNB,在矢状面纵向扫描中,将相同浓度和体积的局部麻醉剂注入由精囊和前列腺底部之间的角度形成的含脂肪的回声三角形中,即所谓的“珠穆朗玛峰征”。PNB可通过添加尖部阻滞来增强效果,即在前列腺尖部和耻骨直肠肌之间的小回声三角形内注射局部麻醉剂,位于前列腺尖部两侧。这种注射旨在阻断前列腺尖部的敏感躯体神经,这些部位通常是前列腺活检时最疼痛的部位。除了尖部阻滞,还可沿前列腺侧方注射局部麻醉剂以阻断沿前列腺走行的神经,或直接向前列腺实质内注射(前列腺内注射)以增强PNB的效果。近期的一项荟萃分析比较了经直肠前列腺活检中描述的局部麻醉技术的疗效,得出结论:在门诊环境下,PPB + ILRA提供了最佳的镇痛效果,其次是PNB + IPLA、PPB、PNB + ILRA和单独的PNB。 -活检技术:使用16或18号弹簧加载活检枪获取前列腺组织芯。将针通过针导向器插入,根据配置,操作者选择采样点。侧射和端射模式不同,通常遵循规则的穿刺路径。激活后,活检枪前进0.5 cm,然后采样1.5 cm的组织,尖端超出采样区域0.5 cm。因此,在激活前,针尖必须距离前列腺包膜0.5 cm,以充分采样外周区。否则,可能会更多地采样移行区,错过肿瘤最常见的位置。此外,将针道向外侧引导可采样外周区的前外侧部分。超声探头必须紧贴直肠壁,这可减少针穿过直肠黏膜时的不适,并可能降低出血的机会。在活检针接触直肠黏膜时,还需注意不要移动探头,以避免不必要的损伤和出血。

显示前列腺经直肠活检的插图 - 活检数量:Hodge等人引入的六分区活检方案,与手指引导的可触及结节活检或超声引导的可疑病变活检相比,显著提高了癌症检出率。最初的方案是从前列腺底部、中叶和尖部双侧各取一个组织芯,遗漏了外周区的尖部和侧方区域。将活检数量从6个增加到12个,癌症检出率提高了31%,并通过提高阴性预测值降低了重复活检的可能性,同时不会增加检测到无意义癌症的可能性。然而,进一步将活检芯数从12个增加到18个或21个,并未产生相同的效果。与12芯活检相比,18或21芯活检方案的癌症检出率并未提高,重复活检的需求也未改变,但21芯方案中检测到无意义癌症的比率高于12芯方案。因此,对于初次活检,扩展的12芯活检方案可提供可接受的癌症检出率和阴性预测值,同时保持较低的无意义癌症检出率。12芯的分布应能充分采样前列腺的尖部和远侧区域(前角)。对根治性前列腺切除术标本中前列腺前部癌症分布的研究发现,最常见的癌症部位是中叶,其次是尖部。尖部完全由外周区组成,如果不专门采样,前尖部可能会被遗漏,这也是重复活检时常见的漏诊部位
且前尖部是重复活检时常见的漏诊部位。向外侧定向采样外周区(远侧芯),能够充分采集外周区前角,提高癌症检出率,因为部分癌症仅能在这些芯中检测到。这些发现表明,采样尖部和远侧区域至关重要。关于移行区采样,虽然15 - 25%的癌症位于移行区,但只有约2%的癌症仅存在于移行区,其余的可通过针对外周区的芯检测到。初次活检时对移行区进行专门采样,并未发现能提高癌症检出率或减少重复活检的需求,因此不推荐。所以,包含尖部和远侧芯的扩展12芯系统活检,能在避免检测无意义癌症或重复活检需求的同时,实现最大程度的癌症检测,是目前的标准操作。3. 重复活检和饱和活检:对于PSA持续升高或直肠指检异常但活检结果为良性的患者,临床上面临两难抉择。此外,既往活检中发现多灶性高级别前列腺上皮内瘤变或非典型小腺泡增生,也可能需要重复活检。在扩展12芯模板中,最常采样不足的部位是前尖部,应作为重复活检的重点部位之一。已知每次后续活检的癌症检出率都会下降。在1051名PSA在4 - 10 ng/ml之间的男性队列中,初次六分区活检的癌症检出率为22%,第二次、第三次和第四次活检的检出率分别降至10%、5%和4%。鉴于重复活检的癌症检出率较低,对于疑似患癌的患者可考虑进行第二次活检,但第三次或第四次活检则无必要。较低的癌症检出率,加上初次扩展12芯活检的癌症检出率提高,表明对于先前活检阴性的患者,若计划重复活检,最好进行饱和活检(>20芯)。重复饱和活检必须对移行区进行采样,已证明可在30%的患者中检测到癌症。四、磁共振成像引导下的活检 多参数磁共振成像(MP - MRI)能够较为准确地识别前列腺病变。多项关于MRI靶向活检的研究得出,其敏感性、特异性、阴性预测值(NPV)和阳性预测值(PPV)分别在91% - 93%、36% - 41%、89% - 92%和51% - 52%之间。基于MP - MRI的前列腺活检主要有三种类型,即腔内磁共振成像靶向活检(MRI - TB)、MRI认知活检(MRI - CB)和MRI融合活检(MRI - FB)。MRI认知活检操作最为简便且成本效益最高,但准确性可能不如其他两种方式。腔内MRI - TB理论上具有优势,因为它利用实时MRI成像进行前列腺活检,不过其效果与MRI融合活检相似,而MRI融合活检似乎是一种折中的选择。MRI技术的主要优势在于能够精确靶向前列腺病变。然而,对于小病变的相关数据有限,且多为传闻。目前尚不清楚在何种病变大小以下,MRI技术具有明显优势。1. 多参数MRI(MP - MRI):高分辨率T2加权图像(T2WI)、动态对比增强MRI(DCE - MRI)和扩散加权成像(DWI)的组合构成了MP - MRI。MP - MRI可用于评估>0.5 cm³的肿瘤。前列腺影像报告和数据系统(PIRADS)是一种用于诊断前列腺癌的评分系统,最初由欧洲泌尿生殖放射学会(ESUR)于2012年提出,随后经过修订,当前版本为2019年发布的PIRADS v2.1。当前的评分系统在前列腺外周区以DWI MRI为主导序列,在移行区以T2加权(T2w)MRI为主导序列。最新版本明确了DCE和DWI中b值的具体应用,特别是在评分2和3中。在评分1和2中评估T2w的变化,以定义包膜内结节和非典型结节。PIRADS v2.1最终评估类别如下: - 非常低(临床显著癌症极不可能) - 低(临床显著癌症不太可能) - 中等(临床显著癌症不确定) - 高(临床显著癌症可能) - 非常高(临床显著癌症极有可能) 使用PIRADS v2对PIRADS 3、4和5病变的前列腺癌检出率分别为35% - 39%、60% - 72%和91%。然而,PIRADS 3、4和5的临床显著前列腺癌(csPCa)发生率分别为17% - 23%、34% - 49%和67% - 77%。使用PIRADS 3或以上作为阈值,有可能避免饱和活检。以此作为MRI - TB的阈值,可诊断出83.8%的csPCa,假阴性率为16.2%。使用标准化PIRADS评分系统的优势在于,其具有中等的观察者间一致性,kappa评分0.55。但MP - MRI对移行区前列腺癌(PCa)的敏感性有限,尤其是在存在良性前列腺增生(BPH)的情况下,这可能导致解读错误。此外,在DWI序列中,BPH结节很容易被误判为恶性病变。还有许多良性和癌前病变可与前列腺癌相混淆,如肉芽肿性前列腺炎、腺病和前列腺上皮内瘤变。2. MRI - TB:MRI - TB的敏感性、特异性、NPV和PPV分别在91% - 93%、36% - 41%、89% - 92%和51% - 52%之间。与标准的经直肠超声活检相比,MRI - TB在识别临床显著前列腺癌(csPca)方面具有更高的敏感性。两者结合可提高活检的阳性率。
MRI - TB方法包括: - MRI - CB:外科医生在进行经直肠超声活检时,通过事先对MRI图像的研究,在脑海中可视化病变位置,从而靶向可疑部位。这涉及图像分析、通过识别各种模式和进行三维空间推理来测量不同距离。MRI - CB在检测前部和尖部肿瘤方面优于系统前列腺活检。它成本低廉,设置简单,在经验丰富的医生手中,效果可能与MRI - FB相当。 - MRI - FB:在前列腺活检过程中,使用市售系统将MP - MRI图像叠加在经直肠超声图像上。市场上有多种系统,它们在配准算法、导航策略、实时跟踪系统和针道记录方法等方面存在差异。每个系统都有其优缺点。用于此目的的最常见系统包括Artemis(Eigen,美国加利福尼亚州格拉斯谷)、UroNav(荷兰阿姆斯特丹飞利浦电子)和Urostation(法国拉特朗什Koelis)。随着经会阴活检的广泛接受,这些系统已进行修改,以适应经会阴模块,从而进行经会阴MRI - FB。BiopSee系统就是为经会阴活检而设计的。使用这些系统的主要局限性在于成本增加和需要额外的学习。这些系统还需要不同专业,尤其是放射科医生之间的协作,以识别和标记病变。此外,在整个操作过程中需要格外注意,因为MP - MRI图像的错误分割以及MP - MRI图像或经直肠超声图像的配准不佳,都可能导致靶向过程中出现问题和错误。多个空间分布的靶点可能有助于克服配准和靶向误差。 - 腔内MRI靶向活检:这种方法在MRI机架内使用MR成像引导实时靶向病变。该操作可使用开放/封闭MRI系统或1.5T/3T MRI系统进行。腔内MRI活检技术的真正优势在于实时性,且可使用任何MRI成像序列进行活检。最常用的设备是DynaTRIM,这是一种用于经直肠活检的便携式设备。该设备使用具有三个自由度的可调节针导向器,固定在检查床下方,患者俯卧位。通过DynaTRIM工作站识别前列腺和病变,然后进行经直肠活检。该操作的学习曲线约为25 - 30例。操作时间约为30分钟,每增加一个病变可能需要额外15分钟。最近,有人建议使用双参数MRI(BP - MRI),即横向T2w图像和扩散加权图像,来识别可疑的前列腺活检病变,因为它们是PIRADS评分中的两个主要序列。这可降低操作成本和时间,并减少患者的对比剂暴露。双参数MRI的阴性预测值为97%,唯一的潜在缺点是由于缺乏动态对比增强图像,无法区分外周区的PIRADS 3和4分。在双参数MRI上,PIRADS 3病变中发现csPCa的几率为17%。
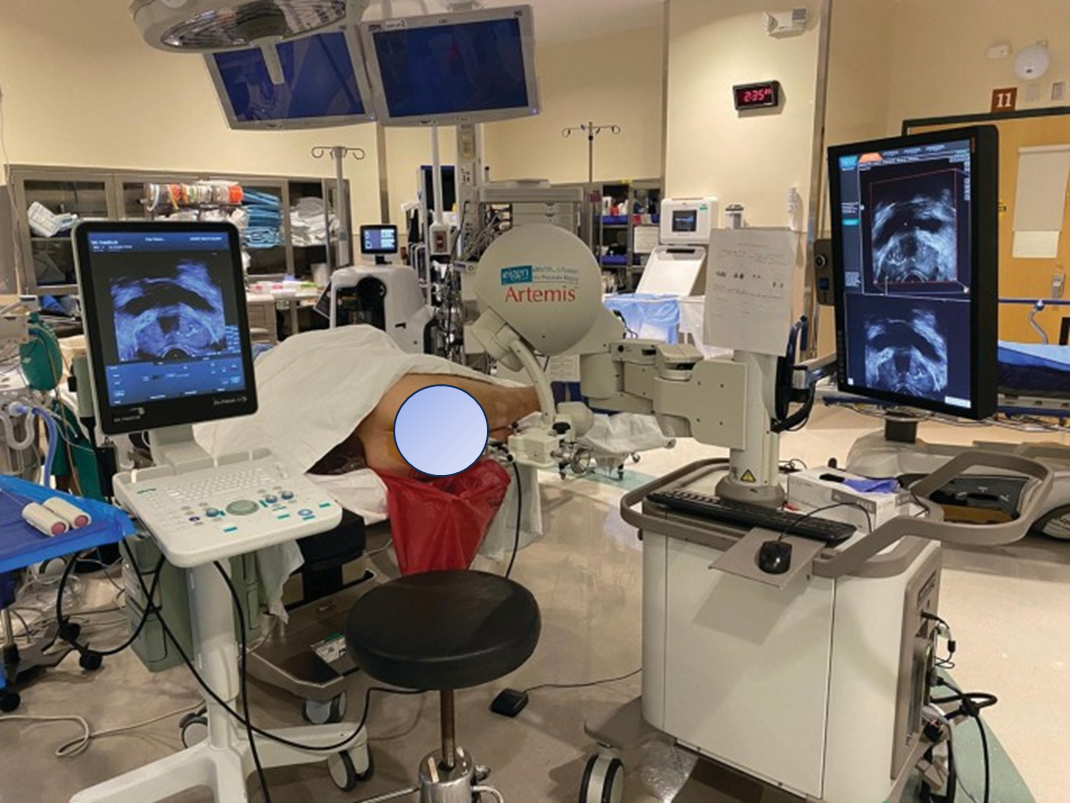
3. 经会阴活检:经直肠活检的缺点促使泌尿外科医生探索经会阴活检。经会阴活检的最大优势是减少抗生素的使用,这使其得到了许多临床医生的更多认可。氟喹诺酮类药物是经直肠前列腺活检中常用的抗生素,但如前所述,其使用存在诸多限制。经会阴活检相对清洁,因为针不穿过直肠。在一项大型多中心研究中,经会阴活检后因感染导致的再入院率为零。经会阴活检的另一个优势是,可使前列腺前部的癌症检出率提高约10%。不过,经会阴活检的缺点是尿潴留发生率增加,且通常需要全身麻醉。也有报道称经会阴前列腺活检在局部麻醉下的可行性。实际上,根据剑桥前列腺活检(CAMPROBE)试验,87%的患者更倾向于局部麻醉下的经会阴活检,而非经直肠超声活检,并且报告疼痛程度更低。经会阴活检在技术上可能比经直肠活检更合理,因为针纵向穿过,活检可局限于外周区,而在经直肠活检中,由于针的方向,活检针可能会碰到中央区或移行区。与经直肠超声活检一样,经会阴活检也可使用各种基于MRI的技术,但需要特殊的规划软件和设备。基于MRI的经会阴活检的检出率与模板活检相似。
4. MRI - TB的成本影响:活检成本最低的是局部麻醉下的标准经直肠超声活检,其次是镇静下的经直肠超声活检、全身麻醉下的经会阴模板活检、镇静下的MRI - FB和镇静下的腔内前列腺活检(成本比为1:1.9:2.5:2.2,p < 0.001)。然而,上述技术的癌症检出率分别为:经直肠超声活检16%、MRI - FB 36%、经会阴模板活检34%(p < 0.001)。在另一项基于模型的成本分析中,与经直肠超声活检相比,MRI - FB每获得一个质量调整生命年的增量成本效益比为1470美元。主要缺点是成本计算基于输入参数,可能无法普遍适用。另一种建议的降低成本措施是使用双参数MRI(BP - MRI),它更便宜,且成本效益与MP - MRI相当。主要缺点是BP - MRI由于缺乏DCE图像,无法正确区分外周区的PIRADS 3和PIRADS 4,因此需要对所有外周区的PIRADS 3病变进行活检。不过,BP - MRI具有97%的高阴性预测值,且检查仅需15分钟。还有一个优势是可通过计算机软件生成ADC图。另一种建议策略是,对于BP - MRI检测到的PIRADS 3病变,使用额外的MP - MRI以避免不必要的活检。
五、并发症和其他任何手术一样,前列腺活检也会伴随一些并发症,尽管危及生命的并发症的绝对风险较低。经直肠前列腺活检后,已报告了多种不良事件,如血尿、血精、直肠出血、尿潴留,以及感染性并发症,如尿路感染、附睾炎、前列腺炎和败血症。1. 出血:出血相关并发症,如血尿、血精或直肠出血,是前列腺活检后最常见且困扰患者的并发症之一。根据不同的定义,10% - 84%的患者会报告活检后血尿,不过只有少数(6.2%)患者认为是中度或重度问题。虽然轻度血尿很常见,但只有少数患者需要导尿(0.4%)或住院(0.14%)。一些作者报告,采样的芯数越多,血尿发生率越高,也有研究将其与较大的前列腺体积和移行区体积相关联。与血尿相似,1.1% - 93%的患者会报告血精,但与血尿不同的是,四分之一的男性对此感到担忧。血精与焦虑和性活动减少相关,持续2 - 4周或约八次射精。年龄、前列腺体积、既往经尿道前列腺切除术和活检芯数是与血精相关的危险因素。直肠出血的发生率在1.3% - 45%之间,通常被认为是轻微的,后果不大,严重危及生命的直肠出血并不常见。2. 活检后感染:大多数前列腺活检后的感染性并发症仅限于有症状的尿路感染或低热性疾病,无需住院治疗。然而,感染性并发症是活检后住院的最常见原因,且近期报告发生率有所增加。在一项跨国、多中心研究中,发热性尿路感染的发生率为3.5%,3.1%的患者需要住院。近期感染性并发症的增加主要归因于氟喹诺酮耐药性。非白人种族、合并症(尤其是糖尿病)、国外旅行、留置导尿管、近期使用抗生素(尤其是氟喹诺酮类)、近期住院和活检前尿培养阳性,被认为是感染性并发症的危险因素。上文已详细介绍了各种预防感染性并发症的抗生素和非抗生素策略。靶向预防是氟喹诺酮耐药性高的地区或活检后感染高风险患者的合适选择。它已被证明可有效预防危及生命的并发症,并且遵循抗生素管理的一般原则,与强化预防不同。最初,人们对这种方法的成本效益存在担忧,因为需要额外的培养和替代抗生素,且活检后感染性并发症的总体发生率较低。此外,并非所有直肠拭子培养出氟喹诺酮耐药大肠杆菌的患者都会发生活检后感染。然而,近期研究表明了靶向预防的有效性和成本效益。在Li等人的一项研究中,通过将感染性并发症的发生率从2.42%降低到0.23%,靶向预防使直接成本降低了37.5%,每100名患者避免的住院天数为7.08天。预防一次感染发作所需筛查的患者数量为45.7。在非抗生素策略中,活检芯数、前列腺周围神经阻滞、前列腺周围神经阻滞所需的注射次数,以及在活检芯之间将活检针浸入福尔马林或聚维酮碘中,均未发现能降低活检后感染的发生率。3. 术后尿潴留:约25%的患者在前列腺活检后下尿路症状会恶化,但急性尿潴留的风险较低,<2%。前列腺体积较大和国际前列腺症状评分(IPSS)较高与尿潴留风险增加相关,且大多数情况下,尿潴留是短暂的,无需手术干预。虽然大多数患者无需术前用药,但对于高危患者,可考虑围手术期使用α受体阻滞剂。六、总结目前,在前列腺活检前使用MRI已成为标准操作并被广泛应用。具体使用的方式取决于技术的可及性和外科医生的偏好。随着经会阴活检的使用增加,活检后败血症的发生率有所下降。未来,前列腺癌的筛查、诊断和治疗技术有望不断发展,为患者带来更好的预后和生活质量。临床医生需要综合考虑各种因素,为患者制定个体化的诊疗方案,同时密切关注并发症的预防和处理,以提高前列腺癌的整体诊疗水平。