前列腺癌是男性中最常见的固体恶性肿瘤,是全球范围内男性癌症相关死亡的主要原因之一。年龄、家族史和种族是其重要的风险因素。前列腺癌的发生发展与多种遗传和染色体异常相关,如 BRCA2 基因突变、8 号染色体的扩增和缺失以及 13 号染色体上 RB1 基因的缺失等。虽然当前有前列腺特异性抗原(PSA)测试、数字直肠检查和前列腺活检等诊断方法,但这些方法存在一定的局限性,如 PSA 的准确性有限,易导致低危患者的不必要侵入性诊断和过度治疗。因此,寻找更准确、敏感和可靠的分子诊断工具和治疗靶点具有重要意义。自1993年miRNA被发现后,研究揭示了其在癌症治疗中的潜力。miRNA在前列腺癌中的失调分为致癌性和肿瘤抑制性两类,可用于诊断、分级、分期和预后评估。抗肿瘤策略包括抑制致癌性miRNA和恢复抗肿瘤miRNA。然而,miRNA的递送挑战需解决以促进其临床应用。未来研究需深入作用机制,开发安全有效的递送系统,并结合多组学技术,以深化对前列腺癌发病机制的理解,为精准治疗提供理论支持。
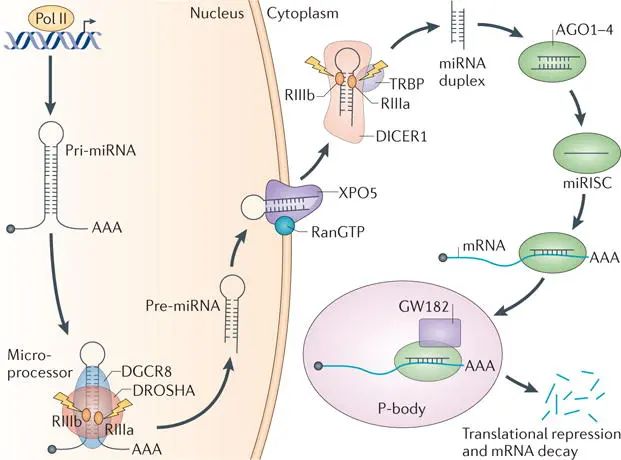
miRNA 的经典生物合成是一个涉及多个复杂加工步骤和从核到细胞质转移的顺序裂解过程。首先,RNA 聚合酶 II 将 miRNA 基因转录为大型前体的原代 miRNA 转录本(pri - miRNA),其具有典型的次级发夹结构,长度从数百到数千个核苷酸不等。在细胞核中,pri - miRNA 由由 Drosha(核糖核酸酶 III 核酸内切酶)、Digeorge 综合征关键区域 8(DGCR8,一种专业的双链 RNA 结合蛋白)和其他伴侣蛋白组成的微处理器复合物精确切割,释放出约 70 个核苷酸的茎环中间前体 miRNA(pre - miRNA)。随后,转运蛋白 Exportin 5(XPO5)与 RAN - GTP 结合形成三元复合物,帮助 pre - miRNA 穿过核孔复合物进入细胞质,避免在易位过程中降解。在细胞质中,pre - miRNA 由另一种核糖核酸酶 III 酶 Dicer 处理,在其末端裂解环,产生成熟的双链 miRNA,长度约为 22 个核苷酸。然后,这些 miRNA 掺入 RNA 诱导的沉默复合物(RISC)中,AGO 蛋白保留导向链并降解乘客链。导向链 miRNA 指导 RISC 复合物特异性识别并结合靶 mRNA 的 3'UTR 中的互补序列,根据互补性的程度,触发靶 mRNA 的翻译抑制或直接降解,从而实现基因表达的转录后调节。
除了经典途径,还存在多种替代途径,这体现了 miRNA 生物合成的复杂性和多样性。例如,mirtron 约占所有 miRNA 产生的 15%,通过转录后剪接直接从内含子产生,形成类似 miRNA 的结构,即使在 Drosha 酶功能有限或不足的情况下也能保持 miRNA 的产生。此外,还有小核仁 RNA(snoRNA)、转移 RNA(tRNA)、小发夹 RNA(shRNA)和 TRNase Z 途径等多个独立途径,以及在 miRNA 成熟阶段的 AGO2 依赖性途径等,它们绕过 Drosha 酶的作用,将各种类型的 RNA 前体加工成 miRNA 样分子。
在发现 miRNA 之前,分子生物学研究主要集中在蛋白质编码基因上,而 miRNA 最初被视为无生物学功能的 “基因组噪声”。1993 年,Lee 等首次发现了小 RNA 分子 LIN - 4 miRNA,它通过与 LIN - 14 基因的互补结合抑制 LIN - 14 蛋白的翻译,调节了秀丽隐杆线虫的发育时间序列,证明了 miRNA 在基因表达调节中的作用。2002 年,Calin 团队发现慢性淋巴细胞性白血病患者中 miR - 15 和 miR - 16 表达水平明显低于健康个体,这一发现首次确认了异常 miRNA 表达与人类肿瘤发生密切相关,引发了癌症中 miRNA 研究的热潮。
miRNA 通过互补配对机制在转录后调节靶 mRNA 表达。由于其种子序列短且互补性不严格,单个 miRNA 可同时靶向数百个不同的 mRNA,且单个 mRNA 也可能被多个 miRNA 调节。这种多靶向能力使 miRNA 在细胞增殖、凋亡、迁移、侵袭、代谢和免疫反应等广泛的生物学过程和信号通路中发挥关键作用。因此,miRNA 表达失调可能导致基因调节网络和细胞功能异常,引发包括癌症在内的各种疾病的发生和进展。
癌症中 miRNA 失调的机制包括生物发生过程中的突变、扩增、缺失和错误,以及关键酶和蛋白质成分的表达和功能障碍,导致 miRNA 加工机制改变和表达异常。在前列腺癌中,DICER1 和 DGCR8 异常升高与 miRNA 失调密切相关。此外,表观遗传学改变,如组蛋白修饰和 DNA 甲基化,也会影响 miRNA 基因的表达状态,导致致癌性 miRNA 表达增加,抗肿瘤 miRNA 表达降低。
在前列腺癌中,一些 miRNA 表现出致癌特性,通过多种机制促进肿瘤的发生和发展。在细胞周期调控方面,细胞周期蛋白和细胞周期蛋白依赖性激酶的协作确保细胞周期正常进展,但肿瘤相关的 miRNA 可诱导细胞周期调节失调,加速细胞周期进展并抑制凋亡,推动前列腺癌发生和进展。例如,miR - 153 过表达导致细胞周期蛋白 D1 表达升高,CDK 抑制剂 p21 表达降低;miR - 21 通过靶向编码区域下调 p27 基因表达;miR - 221/miR - 222 基因簇通过抑制 p27 影响细胞周期分布和细胞增殖,上调 SKP2 促进 p27 降解,升高细胞周期蛋白 A 促进细胞从 G1 到 S 相的过渡,增加细胞周期蛋白 D1 增强细胞增殖能力,增强体外克隆形成和体内肿瘤性;miR - 429 表达降低可抑制前列腺癌细胞增殖并使其停滞在 G1 期。
在凋亡调节方面,凋亡是一种基因控制的生理细胞死亡模式,可维持组织稳定性,但在前列腺癌中,某些 miRNA 的过表达通过干扰凋亡信号通路逃避死亡,促进细胞增殖和肿瘤生长。如 miR - 18a 在前列腺癌标本和细胞系中表达上调,通过直接作用于丝氨酸 / 苏氨酸蛋白激酶 4(STK4),降低 Akt 的去磷酸化,发挥抗凋亡和促进细胞增殖作用;miR - 32 在持续性前列腺癌患者中表达水平高于良性前列腺增生患者,通过同时靶向和抑制 B 细胞易位基因 2(BTG - 2)和磷酸肌醇 - 3 - 激酶相互作用蛋白 1(PIK3IP1),促进细胞增殖并降低凋亡;miR - 21 作为一种在大多数恶性肿瘤中过表达的肿瘤 miRNA,通过抑制肿瘤抑制基因 FBXO11,赋予细胞抗凋亡特性,促进前列腺癌凋亡。
在上皮 - 间质转化(EMT)过程中,EMT 是上皮细胞失去原始表型并获得间充质特性的生化过程,生理 EMT 在胚胎发育和伤口愈合中起关键作用,而病理 EMT 有助于肿瘤细胞增殖和异位生存。在转移性前列腺癌中,失调的 EMT 促进原发性肿瘤细胞侵袭和转移。许多 miRNA 在 EMT 期间调节关键基因和蛋白质的表达,促进癌症转移。例如,miR - 181a 在转移性前列腺肿瘤样品中表达上调,通过特异性靶向 TGIF2 并增加其磷酸化和核内易位,诱导前列腺癌的 EMT 过程;miR - 9 通过下调 Stard13 促进前列腺癌细胞的 EMT 过程,抑制 miR - 9 表达可逆转这一过程;miR - 154、miR - 379 和 miR - 409 等来自 DLK1 - DIO3 簇的 miRNA 被认为是促进前列腺肿瘤诱导、EMT 和骨转移的关键元素。
在血管生成方面,血管生成是从现有血管产生新血管的过程,为肿瘤提供氧气和养分,促进转移灶形成。多种 miRNA 通过不同机制诱导前列腺癌的血管生成。如 miR - 21 过表达直接增强促血管生成因子缺氧诱导因子 1α(HIF - 1α)和血管内皮生长因子(VEGF)的表达,主要通过靶向抑制 PTEN,激活 Akt 和 ERK 信号传导途径;miR - 182 通过调节 HIF - 1 信号传导的负调节剂,导致 HIF - 1α 途径的持续激活,增强血管生成和肿瘤体积增加;miR - 323 通过靶向脂联素受体 1(ADIPOR1)促进前列腺癌细胞中 VEGF - A 的表达,增加癌症血管生成。
此外,由于 miRNA 的多目标性质,单个致癌 miRNA 可同时调节多个细胞学过程,有助于前列腺癌的发展和进展。例如,miR - 93 通过多种途径增强癌细胞的增殖、侵袭和转移能力。
肿瘤抑制 miRNA 通过负调节癌基因和相关信号途径限制肿瘤形成和生长,但在致癌环境中,其表达通常下调,减弱对癌基因的抑制能力,导致肿瘤进展。在前列腺癌中,miR - 34 家族具有广泛的肿瘤抑制作用。miR - 34a、miR - 34b 和 miR - 34c 通过靶向前列腺癌基因在疾病的不同阶段发挥肿瘤抑制功能。miR - 34a 过表达可抑制转移性前列腺癌细胞的增殖和菌落形成,通过下调 Stathmin 1 和 LEF1 等,调节生长分化因子 15(GDF15)的表达,抑制 Wnt 信号通路和细胞的 EMT,降低前列腺癌细胞的迁移和侵袭;miR - 34b 影响 TGF - β/SMAD3 信号通路;miR - 34a 还可降低 CD44 表达,抑制前列腺癌再生和转移。
miR - 145 的激活与 p53 密切相关,其表达降低与 DNA 甲基化和 p53 突变途径有关。miR - 145 可抑制前列腺癌细胞的增殖、迁移和侵袭,促进癌细胞凋亡,抑制骨转移。通过抑制各种生长因子、基质金属蛋白酶 2(MMP - 2)和 9(MMP - 9)的表达,增强 E - 钙粘蛋白表达,降低 PC - 3 细胞的侵入性表型和运动性,抑制 LNCAP 细胞的神经内分泌分化和增殖,保持细胞的上皮特性并预防癌细胞浸润和转移。
此外,miR - 382 通过攻击 COUP - TFII 的下游基因 Snail 和 MMP - 2,抑制前列腺癌细胞的增殖和转移;miR - 122 过表达可抑制前列腺癌细胞的增殖和迁移能力,抑制体内肿瘤形成;miR - 224 下调导致凋亡蛋白 apelin 表达增加,降低前列腺癌细胞的侵入性和迁移能力;miR - 372 对前列腺癌细胞的增殖、迁移和侵袭具有抑制作用,但也有研究表明其存在促进癌细胞增殖和侵袭的情况,其调节机制仍需进一步研究。
临床上,前列腺癌最初的怀疑通常基于 PSA 水平升高和数字直肠检查中的异常,最终诊断需要前列腺活检。然而,PSA 在区分良性和恶性病变方面存在不足,易导致过度诊断和假阳性结果。在过去二十年中,研究人员致力于开发基于患者体液中 miRNA 分析的系统,作为前列腺诊断微创手术的理想替代方案。miRNA 表达谱具有独特的组织和病理特异性,可反映不同癌症阶段的变化,且循环 miRNA 易于获取,在恶劣的温度和 pH 条件下具有很高的生化稳定性。通过多种先进的分子生物学和基因组学技术,如定量逆转录 PCR、miRNA 微阵列、下一代测序、单细胞 RNA 测序、生物信息学分析和原位杂交等,可富集和鉴定与前列腺癌相关的 miRNA。
多项研究表明,多种 miRNA 在前列腺癌的多方面诊断中具有潜在实用性,通过多种 miRNA 联合筛查可进一步提高诊断准确性。例如,Lin 等发现 miR - 34b - 3p、miR - 361 - 5p 和 miR - 200c - 3p 在前列腺癌患者血清中异常表达,这三种 miRNA 的组合可作为识别前列腺癌的血清标志物;Gilyazova 等通过分析早期和晚期前列腺癌患者的微阵列数据,发现 miR - 324 - 3p、miR - 429、miR - 570、miR - 616 和 miR - 423 - 5p 等在不同阶段表达存在差异,可作为前列腺癌分期的诊断标志物;Foj 等观察到前列腺癌患者尿液颗粒中 miR - 141、miR - 375 和 miR - 21 的表达明显高于健康对照;Abramovic 团队发现前列腺癌患者血浆中 miR - 375 - 3p 和 miR - 182 - 5p 的丰度显著高于前列腺增生患者,这两种 miRNA 组合的阳性预测特异性高达 90.2%;Brase 等发现循环 miR - 375 和 miR - 141 是高危前列腺癌的典型标志物,其水平与 Gleason 评分或阳性淋巴结结果相关;Alhasan 等报道的 miR - 200c、miR - 605、miR - 135a、miR - 433 和 miR - 106a 能够区分前列腺癌的惰性和侵袭性特征,准确性至少为 89%。
然而,血清和尿液中 miRNA 的诊断性能虽得到广泛认可,但不同生物样品类型中 miRNA 表达存在差异,检测方法缺乏标准化,可能影响诊断准确性。此外,患者年龄、种族和合并症等因素也可能影响 miRNA 诊断的准确性。因此,后续研究应努力标准化 miRNA 检测过程,考虑这些外部因素,开发更强大的诊断模型。
前列腺癌的预后评估是制定个性化治疗计划和疾病管理的基础,目前的临床和病理指标如 Gleason 评分、肿瘤 - 淋巴结 - 转移分期和 PSA 水平等存在局限性,开发高特异性的预后生物标志物至关重要。众多研究表明,多种 miRNA 在前列腺癌的预后预测中具有巨大潜力。例如,一项研究比较了 40 例前列腺癌患者术前和术后一周血清中循环 miR - 20a 和 miR - 26a 的水平,发现术后两者均降低,其中 miR - 20a 的降低更具统计学意义,可用于监测前列腺癌手术后的残留肿瘤;Peng 等分析了 38 例骨转移和 115 例非骨转移前列腺癌患者组织和血清中 miR - 218 - 5p 的水平差异,发现前列腺癌骨转移时其表达显著降低,与转移性前列腺癌患者的不良预后呈正相关;Wa 等指出下调的 miR - 532 - 3p 诱导 NF - κB 通路的持续激活,对前列腺癌骨转移的预测具有重要临床价值;Larne 团队开发了 miRNA 指数引用(miQ)作为预后工具,通过分析 miR - 96 - 5p、miR - 183 - 5p、miR - 145 - 5p 和 miR - 221 - 5p 的表达,在区分前列腺癌和非癌样本方面比 PSA 检测更有效。
去势抵抗性前列腺癌(CRPC)是前列腺癌在雄激素剥夺治疗后继续进展的一种形式,多种 miRNA 已被证实可反映 CRPC 细胞的分子特征和生物学行为。通过动态监测 miRNA 水平的变化,可对疾病进展发出早期预警,预测 CRPC 转化的可能性,实时评估治疗效果和耐药性。如 Suer 等通过对 20 例复发性和 20 例非复发性前列腺癌患者进行微阵列分析,发现 miR - 424 下调和 miR - 572 上调与前列腺癌复发显著相关;Guo 等证明血浆中 miR - 423 - 3p 的高表达与 CRPC 的发展密切相关,可作为早期预测去势抵抗的生物标志物;此外,研究还发现 miR - 375 和 miR - 1290 与 CRPC 患者的总生存率呈负相关,有助于预测患者预后。
鉴于 miRNA 在疾病进展和转移中的关键调节作用,针对 miRNA 的新治疗策略在医学和药物研发中展现出前景。这些策略主要包括引入 miRNA 模拟物以恢复缺失的肿瘤抑制 miRNA,以及应用 miRNA 拮抗剂抑制过表达的肿瘤促进 miRNA。然而,miRNA 易降解、存在细胞膜屏障、靶向能力差和生物利用度低等问题限制了其临床应用。
为解决这些挑战,大量研究致力于开发更稳定和高效的 miRNA 递送系统,通过化学修饰和特异性靶向策略提高其性能。例如,Takeshita 团队通过尾静脉注射 atelocollagen 载体将 miR - 16 成功递送至前列腺癌骨转移细胞中,显著抑制肿瘤生长;Gauer 等开发了用于递送 miR - 34a 的壳聚糖纳米颗粒(NP)平台,在前列腺癌骨转移异种移植模型中通过诱导自噬和凋亡抑制肿瘤生长并保持骨骼完整性;Ju 等选择 pH 敏感的沸石咪唑酯骨架 - 8(ZIF - 8)纳米载体装载 miR - 491,利用前列腺肿瘤组织的酸性微环境特性,并通过叶酸(FA)修饰增强纳米颗粒对癌细胞的内化,FA@miR - 491 - 5p@ZIF - 8 复合载体可在肿瘤部位快速积累,抑制 C4 - 2 细胞的增殖和迁移,以及裸鼠中 CRPC 的生长;Polyethyleneimine (PEI) 是一种常用的聚合物载体,能与 miRNA 静电结合形成稳定的纳米复合物,具有出色的 miRNA 递送能力。Conte 等通过氨解方法合成了由 PEI 和可生物降解的聚羟基丁酸酯(PHB)组成的阳离子聚合物载体,在 PC - 3 细胞中递送 miR - 124 的效率比市售脂质体转染试剂高 30%,该 PHB - PEI NPs/miR - 124 复合物通过调节肉碱棕榈酰转移酶 1A(CPT1A)抑制细胞增殖、运动和集落形成等致瘤特性;Zhang 等对前列腺癌中特异性吸收的细胞穿透肽聚精氨酸(R11)进行修饰,连接到聚乙烯亚胺(PEI)上制备 R11 - SSPEI 纳米复合物,可有效将 miR - 145 递送至腹膜小鼠前列腺肿瘤中,抑制肿瘤生长并延长生存时间;Nagesh 等开发了一种通过 PEI 和聚乙二醇(PEG)包覆的 PEI - PEG 共轭磁性纳米颗粒平台,PEI 增强 miR - 205 结合效率,PEG 确保纳米颗粒稳定性并减少聚集,该平台有效将 miR - 205 转染到化疗耐药的前列腺癌细胞中,恢复其对化疗药物的敏感性,但该研究未探索磁性纳米颗粒在体内的肿瘤靶向潜力,若利用外部磁场可引导纳米颗粒精确聚集在肿瘤部位,提高治疗区域浓度并减少对正常组织的副作用。
一些研究将前列腺特异性膜抗原(PSMA)抗体或适配体与纳米颗粒结合,利用 PSMA 蛋白在前列腺癌细胞表面的高表达特性,实现对癌细胞的特异性识别和 miRNA 的精确靶向递送。此外,脂质体纳米颗粒、聚合物纳米颗粒、电穿孔技术和病毒载体等先进递送系统结合靶向修饰,极大地提高了 miRNA 递送的精确性。在临床前研究中,基于 miRNA 的疗法在多种癌症模型中显示出巨大的治疗潜力,但要成为癌症治疗的主流手段仍有许多瓶颈需要克服,因此,加速针对 miRNA 递送的纳米技术的开发和创新尤为重要。
前列腺癌作为男性最常见的癌症之一,早期症状隐匿,常被诊断为转移阶段,导致死亡率较高。现有的筛查和诊断方法,如 PSA 检测和直肠指检,准确性和可靠性不足,往往依赖前列腺活检来确诊,这可能带来假阴性结果和感染等风险。在此背景下,临床迫切需要开发非侵入性生物标志物,以提高早期检测的诊断价值,改善患者预后,降低癌症死亡率。