
胸腺瘤和胸腺癌统称胸腺上皮肿瘤,起源于胸腺。前纵隔最常见的原发肿瘤是胸腺瘤,而胸腺癌发病率则较为罕见。据统计,国内胸腺瘤切除术后10 年总生存率为89.5%,约5.8%患者发生复发,胸腺癌术后10 年生存率47.9%。国际上,胸腺瘤和胸腺癌的5年生存率分别为67.1%和55%。2022 年12 月美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)发布了2023 年第1版胸腺瘤和胸腺癌临床实践指南(以下简称《指南》)。
(一)病理与临床胸腺瘤(thymoma)是指来源于胸腺上皮细胞的原发肿瘤。前纵隔肿瘤中约50%为胸腺瘤,多见于40~50岁。临床症状主要是重症肌无力。肿瘤多位于前纵隔中部,内可见囊变、出血,偶有钙化。胸腺瘤有侵袭性和非侵袭性之分,侵袭性胸腺瘤突破包膜生长,侵犯纵隔内其他组织,术后易复发,可发生转移。在评估纵隔肿块时,与胸部CT检测相比,胸部MRI可以更好地区分恶性肿瘤、囊肿或胸腺增生,从而可能避免非必要的胸腺切除术。强调胸部MRI也更能区分胸腺恶性肿瘤和胸腺增生,相对更加严谨。
1.X线表现:胸片见第4~5胸椎平面软组织肿块自纵隔突出,圆或椭圆形,边缘光整。侧位见肿块位于前中纵隔。
2.CT表现:非侵袭性胸腺瘤CT平扫示前纵隔内类圆形软组织肿块,多数密度均匀。增强后均匀强化,囊变的部分呈低密度且无强化表现。侵袭性胸腺瘤肿块常较大,密度不均匀,包膜不完整,周围脂肪组织层消失,侵犯邻近的胸膜、心包膜等结构,并可伴胸腔积液。
3.MRI表现:平扫示肿块与肌肉信号相似,增强后轻度强化。肿块内可有囊变,T1WI呈低信号,T2WI呈高信号。侵袭性胸腺瘤包膜不完整,环绕肿块的纵隔脂肪被侵蚀
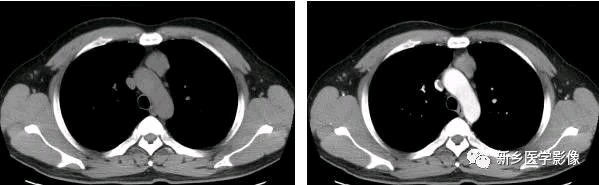
非侵袭性胸腺瘤
a.CT图像CT平扫示前上纵膈主动脉弓与胸骨间软组织密度肿块,密度均匀,边缘浅分叶状b. CT增强示肿块均匀强化,肿块与主动脉弓之间脂肪间隙清晰
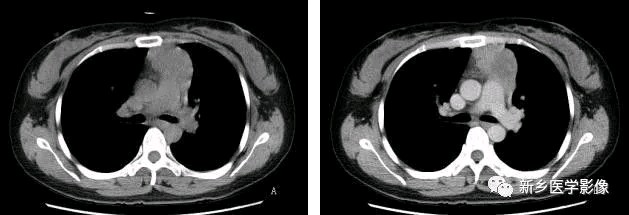
侵袭性胸腺瘤CT图像
a. CT平扫示肺动脉与胸骨间肿块,密度尚均匀,形态不规则b. CT增强示肿块不均匀强化,见低密度囊变区域,肿块与肺动脉之间脂肪间隙消失,肺动脉壁模糊
胸内甲状腺:可以是颈部甲状腺肿块长大进入胸腔内,也可以是异位胸内甲状腺病变,位置较高,多近胸廓入口处,较大肿块将气管向对侧推移,肿块随吞咽动作上下移动。CT平扫示肿块密度稍高于胸壁肌肉,常见高密度钙化灶及低密度的囊变或出血灶。增强示肿块实质部分明显持续强化。MRIT1WI、T2WI肿块呈等信号,实质部分明显强化,囊变区域呈明显的T1WI低信号、T2WI高信号改变。
胸内结节性甲状腺肿CT图像
a. CTCT平扫示上纵隔气管两侧甲状腺软组织密度肿块,密度欠均匀,气管受压移位、变形 b. 增强后明显不均匀强化
WHO将胸腺瘤的病理分型分成以下几种:
A型:起源于胸腺上皮的肿瘤,由梭形或卵形细胞组成,混有少量不成熟淋巴细胞AB混合型:胸腺上皮性肿瘤,由淋巴细胞稀少的梭形细胞成分(A型)和富于淋巴细胞的(B型)成分及明显的不成熟T细胞构成的胸腺上皮肿瘤。B型:按照淋巴细胞和上皮细胞的比例,又将B型分成以下3种。
B1型:组织结构与细胞形态都非常接近正常的胸腺结构。富含淋巴细胞,有少量上皮细胞。
B2型:由大量不成熟T淋巴细胞及多角形上皮细胞簇组成,淋巴细胞与上皮细胞比例接近。上皮细胞簇数量比B1型或正常胸腺多。
B3型:是一个以上皮细胞为主的胸腺肿瘤,淋巴细胞稀少。C型:即胸腺癌。2004年删除了胸腺瘤中C型类别,将胸腺癌另列为一类。
从病理的角度来看,A型和AB型的生物学行为与良性疾病相似。B型常合并重症肌无力和其他免疫学疾病。B1型恶性程度略高于A型和AB型,是低度恶性肿瘤,B2型胸腺恶性程度高于B1型,低于B3型。胸腺癌和其他器官恶性肿瘤相似,复发率高,预后差。
恶性程度:C > B3 > B2 > B1 > AB > A
但关于胸腺瘤的治疗不能单纯靠病理分型来作为判断标准。原因:1. 即使是良性的胸腺瘤也有复发的可能性2. 手术中虽已明确发现病灶侵犯至肺及心包,但是病理检查结果却显示未见肿瘤包膜浸润。因此,必须结合手术中的临床分期来综合判断。
最常使用的临床分期是Masaoka-Koga分期:
Ⅰ 肉眼和镜下肿物包膜完整
Ⅱa镜下侵透包膜
Ⅱb肉眼侵犯胸腺或周围脂肪组织,或与纵隔胸膜、心包粘连,但镜下没有侵犯
Ⅲ肉眼侵犯邻近器官(如心包,大血管或肺部)
Ⅳa胸膜或心包转移
Ⅳb淋巴或血行转移
胸腺肿瘤的初始治疗所有患者均应当由具有胸腺癌和胸腺瘤治疗、管理经验丰富的MDT管理。应主要关注胸部肿瘤,由胸外科医生仔细评估确定可切除性,局部晚期(不可切除)和Ⅱ期以上的可切除性应由MDT小组评估(可切除指能够完全切除或R0切除),并在MDT 会诊中根据需要选择与肿瘤内科会诊。治疗方法根据可切除性选择。
评估为可切除的胸腺肿瘤,目前的手术方法主要有微创(minimally invasive surgery,MIS)胸腺切除术和开放(open thymectomy,OT)胸腺切除术。随着时间的推移,MIS在胸腺瘤切除术中的应用已经显著增加,MIS 在胸腺瘤切除术中的R0 切除率与OT相似[30]。研究[31]表明,在选定的胸腺恶性肿瘤患者中,MIS 相比于OT也仅在出血量减少和住院时间缩短方面差异有统计学意义,在手术时间和并发症方面并无差异。因此,建议在可以达到完全切除肿瘤并且在外科医生掌握微创专业技术知识的情况下可以考虑MIS。但同时并不是所有患者都适合MIS,建议在膈神经、无名静脉或其他大血管受累等高度怀疑纵隔结构侵犯的患者,最好接受OT治疗。
手术前,应评估患者的重症肌无力体征和症状,并在手术前进行药物控制。手术中完全切除连续性和非连续性病变,检查胸膜表面是否有胸膜转移,若有且可切除则以达到完全大体切除为宜。肿瘤完全切除过程中可能需要切除邻近结构。胸腺癌切除时应考虑适当的系统淋巴结取样,因为这样可以进行更准确的病理分期。此外为防止严重呼吸系统并发症,应尽量避免双侧膈神经切除。手术时手术夹应放置于近边缘区域、残留病灶或未切除的肿瘤黏附于正常组织的区域,以帮助指导精准放疗。
R0切除(无残留肿瘤)
术后治疗对于胸腺瘤、无包膜侵犯的胸腺癌及Ⅰ期肿瘤的患者,无需采取术后治疗。在术后管理上,每6~12 个月复查胸部CT,监测复发情况,持续2 年,之后胸腺癌5年内每年复查1 次,胸腺瘤10年内每年复查1次。对于侵犯包膜的胸腺瘤或胸腺癌及Ⅱ~Ⅳ期胸腺肿瘤患者,考虑术后放疗,总剂量45~50 Gy。在术后管理上,每6 个月检查胸部CT造影,监测复发,持续2 年,之后胸腺癌5年内每年复查1次,胸腺瘤10 年内每年复查1次。
R1切除(显微镜下残留肿瘤)术后治疗
对于胸腺瘤患者采用术后放疗,胸腺癌患者采用术后放疗加化疗(此处治疗方法意见各不相同),放疗剂量为54 Gy。术后管理上,每6 个月检查胸部CT造影监测复发,持续2 年,之后胸腺癌5年内每年复查1次,胸腺瘤10 年内每年复查1次。
R2切除(肉眼下残留肿瘤)术后治疗对于胸腺瘤和胸腺癌患者都采用根治性放疗加化疗(此处治疗方法意见各不相同),放疗总剂量为60~70 Gy。术后管理复查情况上同R1 切除部分。
(六)肿瘤局部晚期、晚期和复发的治疗
胸腺瘤或胸腺癌局部晚期的治疗
评估为不可切除的局部晚期肿瘤需进行同步放化疗,施行根治性放疗,放疗剂量为60~70 Gy。对于有切除可能性的肿瘤,先实行化疗,后检查胸部CT造影,对有临床指征的患者进行FDG PET/CT检查(全身或颅底至大腿中部),确定是否可切除。若为不可切除,进行放疗,选择性进行化疗。若评价为可切除,进行手术切除原发肿瘤和孤立转移灶,并考虑术后放疗。术后管理同R1切除的复查原则。
孤立性转移或同侧胸膜转移 对于有切除可能性的肿瘤,原则同有切除可能性的肿瘤。对于确定可切除的肿瘤,行切除术后考虑化疗或放疗。对于医学上无法手术切除的肿瘤考虑局部治疗或全身治疗。局部治疗可包括影像引导下的热消融或放疗。对于复发患者, Bott等的研究中, 25 例患者在初次切除后出现复发或疾病进展(10 例胸腺癌,15例胸腺瘤),其中11例(44%)接受了共16 次的再次手术(1~4 次),半数的再次手术获得R0 切除(16 中有8例,50%),但大多数手术患者(11例中的9 例,82%)再次复发。其认为再切除后大多数患者会再次复发,因此只应在选定的患者中,考虑行再次手术治疗。