
- H
- I
- L
- S
- V
临床研究是医药创新产业的关键环节,对打造可持续发展的、具备国际竞争力的医药创新生态系统至关重要。2017年10月8日,中共中央办公厅和国务院办公厅发布《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,在改革临床试验管理、加快上市审评审批、促进药品创新等方面,提出了若干项重大举措。
图表 1国家药品监督管理局发布备案管理办法
生命健康产业,一直是深圳市重点发展领域,作为全国医疗器械产业重要聚集区,截至2017年12月底,全市共有取得一类医疗器械产品生产备案及二、三类医疗器械生产许可证的企业731家。尚未取得生产许可证,产品仍处在临床试验前的研发团队数量庞大。长期以来,上述医疗器械生产研发企业饱受临床试验机构资源不足的制约。
为响应国家号召,顺应我市加快医药产业升级提速的要求,缓解医药产业临床研究需求与临床试验机构资源数量不足的矛盾,我院积极组织力量筹建临床试验机构,并迅速开展医疗器械备案工作。在通过了严格的注册审核后,将各类信息提交药品监督管理部门进行资料核查、存档、备查。日前,喜讯传来,医院已顺利通过国家药品监督管理局的医疗器械备案(备案号201800652),成为广东省第68家、深圳市第16家、宝安区第2家备案成功的医疗器械临床试验机构。此次,医院共有呼吸内科、妇科、泌尿外科、内分泌、心血管内科、麻醉科、康复医学科7个专业组通过备案。

图表 2医疗器械临床试验机构备案管理信息系统已可查询到我院信息
通过备案,预示着我院已具备开展医疗器械临床试验的资质,对我院进一步提高临床研究水平具有重要意义。各备案专业科室需建立起对临床试验意义和风险的正确认识和敬畏之心。临床试验机构办公室将严格按照相关GCP要求,加强对试验项目的监管,促进临床试验质量不断提高。伦理委员会办公室将在今后涉及人体医学研究试验的所有过程中,严格遵循保护受试者及其相关人员的基本伦理道德原则,并实现规范化跟踪管理,确保我院高质量的医学研究工作顺利开展。
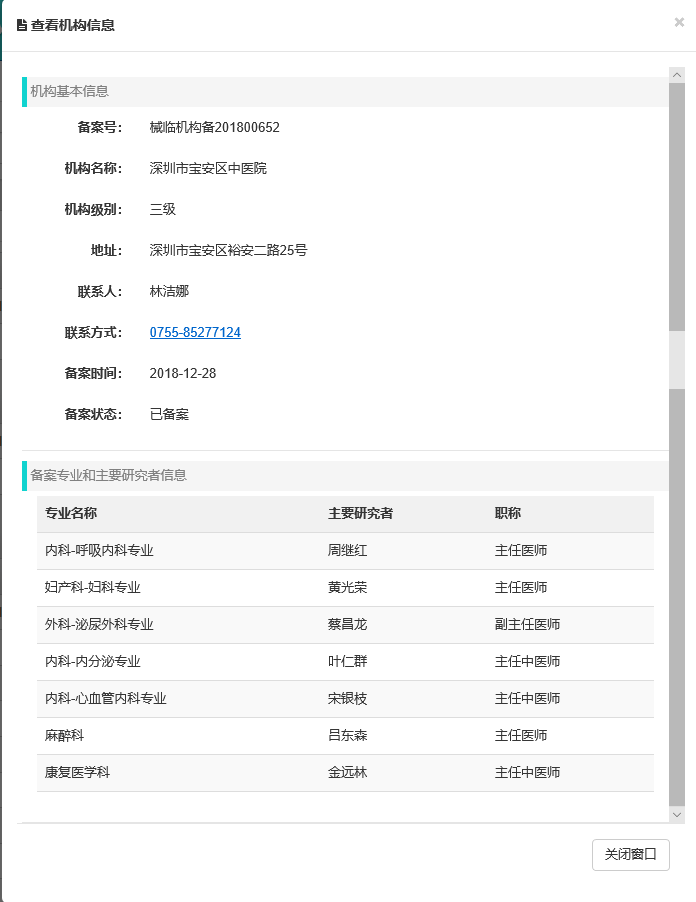
图表 3医院备案信息及备案专业
成功备案医疗器械临床试验的医疗机构,将有利促进我院科研竞争力和医疗器械产品领域产、学、研、用相互转化水平,为医院向科技研究型医院转变增添浓重的一笔。

图表 4朱美玲院长点击提交备案
与此同时,临床试验机构办公室及伦理委员会办公室正在努力申请国家药品临床试验机构的认定,早日满足我院药物临床试验申报专业参与高水平、多中心药物临床试验研究的需求,助力我院医教研及新药临床研究水平提升。